解题方法
1 . 中国政府承诺:力争 的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。
的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。 的捕集与利用成为当前研究的热点。
的捕集与利用成为当前研究的热点。
Ⅰ.“氨法”捕集二氧化碳是实现“碳中和”的重要途径之一
反应的化学方程式为: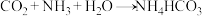 。
。
完成下列填空:
(1)写出氮原子的核外电子排布式_______ ,写出 分子的电子式
分子的电子式_______ 。
(2)用方程式表示二氧化碳溶于水溶液呈现酸性的原因_______ 。
(3)组成 的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是
的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是_______ (写出一种,下同);由其中任意三种元素组成的离子化合物可以是_______ 。
(4)上述氨法吸收废气中 时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。
时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。_______
Ⅱ.我国化学家研究在铜基催化剂作用下将 高效转化为甲酸,合成铜基催化剂时有一步反应为:
高效转化为甲酸,合成铜基催化剂时有一步反应为: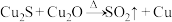 (未配平)。
(未配平)。
(5)配平上述化学方程式_______ 。若反应中转移 电子,则生成气体在标准状态下的体积为
电子,则生成气体在标准状态下的体积为_______ L。
 的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。
的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。 的捕集与利用成为当前研究的热点。
的捕集与利用成为当前研究的热点。Ⅰ.“氨法”捕集二氧化碳是实现“碳中和”的重要途径之一
反应的化学方程式为:
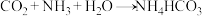 。
。完成下列填空:
(1)写出氮原子的核外电子排布式
 分子的电子式
分子的电子式(2)用方程式表示二氧化碳溶于水溶液呈现酸性的原因
(3)组成
 的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是
的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是(4)上述氨法吸收废气中
 时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。
时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。Ⅱ.我国化学家研究在铜基催化剂作用下将
 高效转化为甲酸,合成铜基催化剂时有一步反应为:
高效转化为甲酸,合成铜基催化剂时有一步反应为: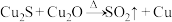 (未配平)。
(未配平)。(5)配平上述化学方程式
 电子,则生成气体在标准状态下的体积为
电子,则生成气体在标准状态下的体积为
您最近一年使用:0次
名校
2 . 磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产中的还原剂。完成下列填空:
(1)P元素在周期表中的位置是_______ ,NaH2PO2中涉及到四种元素,它们的原子半径由大到小的顺序为_______ 。写出与磷同周期的主族元素中,离子半径最小的元素的最高价氧化物对应水化物的化学式_______ 。
(2)白磷(P4)在过量的热NaOH溶液中,会生成PH3气体和NaH2PO2,写出该反应的化学方程式_______ ,已知白磷中只存在P-P键,画出白磷的球棍模型_______ 。
(3)已知H3PO2是一种弱酸,写出其电离方程式_______ ,如何实验证明其是一种弱酸_______ 。
(4)NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是_______ (选填编号)。
a.升高 b.降低 c.既升高又降低
(5)Ba(H2PO2)2溶液中加入盐酸制备H3PO2,写出该反应的离子方程式_______ 有人说应该用硫酸代替盐酸,请说明用硫酸代替盐酸的优点_____ 。
(1)P元素在周期表中的位置是
(2)白磷(P4)在过量的热NaOH溶液中,会生成PH3气体和NaH2PO2,写出该反应的化学方程式
(3)已知H3PO2是一种弱酸,写出其电离方程式
(4)NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是
a.升高 b.降低 c.既升高又降低
(5)Ba(H2PO2)2溶液中加入盐酸制备H3PO2,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 下列化学用语对事实的表述不正确 的是
A.硬脂酸与乙醇的酯化反应: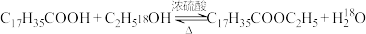 |
B.常温时, 氨水的 氨水的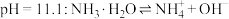 |
C.由Na和Cl形成离子键的过程: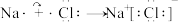 |
D.电解精炼铜的阴极反应: |
您最近一年使用:0次
名校
解题方法
4 . 下列离子方程式或电离方程式书写正确的是
| A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B.硝酸银溶液中加入铁粉:Ag++Fe=Fe2++Ag |
C.硫酸氢钠熔化状态下的电离方程式:NaHSO4=Na++HSO |
| D.氟化氢的电离方程式:HF=H++F— |
您最近一年使用:0次
名校
解题方法
5 . 酸的强弱除与本身性质有关外,还与溶剂有关。HA和HB在水中皆为弱酸,且酸性HA<HB,在液氨中两者皆为强酸。则下列表述正确的是
| A.液氨中:NaA+HCl→NaCl+HA | B.水溶液中:NaB+HA→NaA+HB |
| C.液氨中:HB→H++B- | D.水溶液中的pH:NaA<NaB |
您最近一年使用:0次
6 . Al(OH)3在水中的电离平衡书写正确的是
| A.Al(OH)3⇌Al3++OH- |
B.Al(OH)3⇌H++AlO +OH- +OH- |
C.Al3++OH- ⇌Al(OH)3⇌ H++AlO +H2O +H2O |
D.Al3++3OH-⇌Al(OH)3⇌ H++AlO +H2O +H2O |
您最近一年使用:0次
2020-12-22更新
|
368次组卷
|
2卷引用:上海市奉城高级中学2018-20219学年高二上学期期中考试化学试题
名校
解题方法
7 . 下列电离方程式中,正确的是
A.CH3COONH4=CH3COO-+NH | B.H2S 2H++S2- 2H++S2- |
C.NaHCO3=Na++H++CO | D.Ba(OH)2 Ba2++2OH- Ba2++2OH- |
您最近一年使用:0次
名校
8 . 下列电离方程式中,正确的是( )
| A.CH3COOH=CH3COO-+H+ | B.NaHCO3=Na++HCO3- |
C.KClO3 K++ClO3- K++ClO3- | D.BaSO4=Ba2++S2-+4O2- |
您最近一年使用:0次
解题方法
9 . Li-SOCl2电池采用LiAlCl4的SOCl2溶液为电解质溶液,是目前比能量最高的化学电源,具有电压高.储存寿命长.工作温度范围宽.成本低等优点。
(1)该电池的工作原理为:4Li+2SOCl2=4LiCl↓+SO2↑+S↓,该反应的还原产物为__________ ,若生成标准状况下气体11.2L,则转移电子的数目为_____________ ;
(2)SOCl2可用于AlCl3·6H2O制备无水AlCl3,请结合离子方程式解释不采用直接加热晶体的方法除去结晶水的原因_____________________________________________________________ ;
(3)解释Li-SOCl2电池组装必须在无水条件下的原因_______________________________ ;
(4)工业制硫酸中,SO2的催化氧化采用常压而不是高压的原因______________________ ;
(5)向NaOH溶液中缓慢通入SO2至过量,反应过程中某微粒X的物质的量浓度随着通入SO2体积的变化如图所示,该微粒X为_____________ ,SO2过量时溶液仍然存在微粒X的原因____________________________ 。
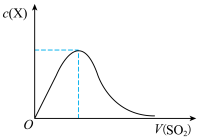
(1)该电池的工作原理为:4Li+2SOCl2=4LiCl↓+SO2↑+S↓,该反应的还原产物为
(2)SOCl2可用于AlCl3·6H2O制备无水AlCl3,请结合离子方程式解释不采用直接加热晶体的方法除去结晶水的原因
(3)解释Li-SOCl2电池组装必须在无水条件下的原因
(4)工业制硫酸中,SO2的催化氧化采用常压而不是高压的原因
(5)向NaOH溶液中缓慢通入SO2至过量,反应过程中某微粒X的物质的量浓度随着通入SO2体积的变化如图所示,该微粒X为

您最近一年使用:0次
解题方法
10 . 用碳化铝制取甲烷的化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑。下列有关化学用语表示正确的是( )
| A.铝离子的电子排布式:1s22s22p63s23p1 |
| B.水分子的结构式:H—O—H |
C.甲烷的比例模型: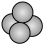 |
| D.氢氧化铝的电离方程式:H++AlO2-+H2O=Al(OH)3=Al3++3OH- |
您最近一年使用:0次



