名校
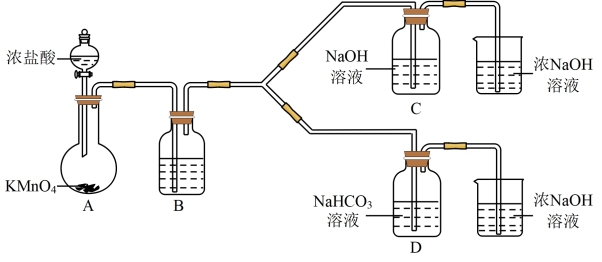
1 . 某研究性学习小组欲用如图所示的装置证明酸性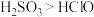 。已知:
。已知:
 ,下列有关说法正确的是
,下列有关说法正确的是

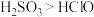 。已知:
。已知:
 ,下列有关说法正确的是
,下列有关说法正确的是
A.通过本实验能得出非金属性: |
| B.A中的酸不用浓硫酸的原因是浓硫酸与亚硫酸钠发生氧化还原反应,不能制得二氧化硫气体 |
C.C中发生的反应离子方程式为 |
D.该同学后来查资料发现 ,所以认为该装置无法用来则证明酸性: ,所以认为该装置无法用来则证明酸性: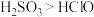 |
您最近一年使用:0次
2022-06-01更新
|
315次组卷
|
2卷引用:湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题
2 . 25℃时CH3COOH的 、HF的
、HF的 ,下列说法正确的是
,下列说法正确的是
 、HF的
、HF的 ,下列说法正确的是
,下列说法正确的是A.分别测定某HF溶液、醋酸溶液的pH,前者小于后者,可以证明HF的 |
B.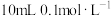 的HF溶液中加入 的HF溶液中加入 的NaOH溶液,溶液中水的电离程度与纯水相同,V(NaOH)可能小于或大于10mL 的NaOH溶液,溶液中水的电离程度与纯水相同,V(NaOH)可能小于或大于10mL |
C.向 的HF溶液中加入 的HF溶液中加入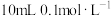 的NaOH溶液充分反应,所得溶液中 的NaOH溶液充分反应,所得溶液中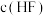  |
D.将 的HF溶液与 的HF溶液与 的醋酸混合,HF的电离度增大 的醋酸混合,HF的电离度增大 |
您最近一年使用:0次
名校
3 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法并测定相关反应的平衡常数。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I制备消毒液(夹持装置略)
(1)制备NaClO的离子反应方程式___________ 。
(2)结合资料i,写出D中反应的化学方程式___________ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为 。
。
设计实验a证实了假设1成立。NaClO氧化I2生成 的离子方程式是
的离子方程式是___________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是___________ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由___________ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据___________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和
 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。iii.碘单质能与I-反应:I2+I-

 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I制备消毒液(夹持装置略)

(1)制备NaClO的离子反应方程式
(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | |溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体,再加入1mol/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:过量的NaClO将反应生成的I2氧化为
 。
。设计实验a证实了假设1成立。NaClO氧化I2生成
 的离子方程式是
的离子方程式是假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是
(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近一年使用:0次
2022-05-31更新
|
509次组卷
|
3卷引用:北京市第一六六中学2022届高三下学期三模化学试题
名校
解题方法
4 . 2019年度诺贝尔化学奖奖励锂电池的发明者,锂离子电池已经彻底改变了我们的生活。如果废旧电池处理不当就会对环境造成严重污染,影响人们的健康生活。一种以废旧锂离子电池的正极材料(主要含LiCoO2、Al、C等)为原料制备CoC2O4•2H2O的流程如图1:

(1)除铝时发生反应的离子方程式为_______
(2)灼烧的主要目的是_______ ,实验室中灼烧实验用到最重要的仪器是_______
(3)还原步骤在70℃左右,LiCoO2发生反应的化学方程式为_______ ,若用盐酸代替H2SO4和H2O2,也可以达到目的,但其缺点是_______
(4)沉淀时,证明Co2+已经沉淀完全的实验操作与现象是_______
(5)已知:NH3•H2O⇌ +OH-,Kb=1.8×10-5,H2C2O4⇌H++
+OH-,Kb=1.8×10-5,H2C2O4⇌H++ ,Ka1=5.4×10-2,
,Ka1=5.4×10-2, ⇌H++
⇌H++ Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH
Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH_______ 7(填“>”或“<”或“=”)

(1)除铝时发生反应的离子方程式为
(2)灼烧的主要目的是
(3)还原步骤在70℃左右,LiCoO2发生反应的化学方程式为
(4)沉淀时,证明Co2+已经沉淀完全的实验操作与现象是
(5)已知:NH3•H2O⇌
 +OH-,Kb=1.8×10-5,H2C2O4⇌H++
+OH-,Kb=1.8×10-5,H2C2O4⇌H++ ,Ka1=5.4×10-2,
,Ka1=5.4×10-2, ⇌H++
⇌H++ Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH
Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH
您最近一年使用:0次
2021-08-19更新
|
600次组卷
|
3卷引用:江苏省宿迁市沐阳如东中学2021-2022学年高三8月第一次调研(线上)化学试题
江苏省宿迁市沐阳如东中学2021-2022学年高三8月第一次调研(线上)化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】11内蒙古包钢第一中学2021-2022学年高三下学期一模检测(B)化学试题
5 . 下列说法正确的是
| A.将Na2CO3溶液从常温加热至80℃,溶液的碱性增强 |
| B.升高温度,RCl盐溶液的pH减小,一定证明ROH是弱电解质 |
| C.298K时,pH=8的NaOH溶液和pH=6的NH4Cl等体积混合,溶液显中性 |
| D.在氨水的稀溶液中,加入某浓度的氢氧化钠溶液,一定会抑制氨水的电离,溶液的pH增大 |
您最近一年使用:0次
6 . 已知室温下将H2S气体通入饱和NaHCO3溶液中,存在平衡①,其实质上由两个可逆过程②、③共同构成,平衡常数如表所示:
下列说法正确的是
序号 | 平衡 | 平衡常数 | 反应热 |
① |  |
|
|
② | 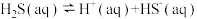 |
|
|
③ | 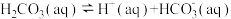 |
|
|
| A.由于②与③为酸的电离,属于物理变化,故①不属于化学反应 |
B.在NaHS饱和溶液中通入 气体,可以生成 气体,可以生成 |
C.上述转化可以证明相同条件下 的酸性强于 的酸性强于 |
D.该反应的平衡常数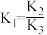 ,故 ,故 |
您最近一年使用:0次
2021-03-06更新
|
272次组卷
|
2卷引用:浙江省台州市2021届高三11月选考科目教学质量评估(一模)试题化学学科
名校
解题方法
7 . CO2既是温室气体,也是重要的化工原料,CO2的捕捉和利用是我国能源领域的一个重要战略方向。
(1)已知:①4H2(g)+2O2(g) 4H2O(g)△H=-967.2kJ/mol;.
4H2O(g)△H=-967.2kJ/mol;.
②CH4(g)+2O2(g) CO2(g)+2H2O(g)△H=-802.0kJ/mol。
CO2(g)+2H2O(g)△H=-802.0kJ/mol。
则CO2(g)+4H2(g) CH4(g)+2H2O(g)△H=
CH4(g)+2H2O(g)△H=______ kJ/mol。
(2)在体积为1L的密闭恒容容器中,充入4molH2和1molCO2,发生反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)测得温度对CO2的平衡转化率(%)和催化剂催化效率的影响如图所示。
CH4(g)+2H2O(g)测得温度对CO2的平衡转化率(%)和催化剂催化效率的影响如图所示。

①欲提高CO2的平衡转化率,可采取的措施有______ (填序号)
A.通入惰性气体 B.升高温度 C.增加CO2浓度 D.增加H2浓度
②下列说法正确的是_____ (填序号)。
A.平衡常数大小:KN<KM
B.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于点M1
C.其他条件不变,加入催化剂可以降低该反应活化能,△H不变
D.当压强或混合气体的密度保持不变时均可证明化学反应已达到平衡状态
③已知M点总压为lMPa,该反应在此温度下的平衡常数Kp=______ MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数)
(3)工业上用CO2和H2反应可合成甲醇(CH3OH)。甲醇燃料电池具有能量转化率高、电量大的特点而被广泛应用,甲醇碱性燃料电池中甲醇加入到______ (填“正”或“负”)极,该电极的电极反应式为______________________ 。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3,写出得到Na2CO3的离子方程式:____________ ,若某次捕捉后得到pH=10的溶液、则溶液中c( ):c(
):c( )=
)=_______ ,[常温下K1(H2CO3)=4.4×10-7K2(H2CO3)=5×10-11]
(1)已知:①4H2(g)+2O2(g)
 4H2O(g)△H=-967.2kJ/mol;.
4H2O(g)△H=-967.2kJ/mol;.②CH4(g)+2O2(g)
 CO2(g)+2H2O(g)△H=-802.0kJ/mol。
CO2(g)+2H2O(g)△H=-802.0kJ/mol。则CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H=
CH4(g)+2H2O(g)△H=(2)在体积为1L的密闭恒容容器中,充入4molH2和1molCO2,发生反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)测得温度对CO2的平衡转化率(%)和催化剂催化效率的影响如图所示。
CH4(g)+2H2O(g)测得温度对CO2的平衡转化率(%)和催化剂催化效率的影响如图所示。
①欲提高CO2的平衡转化率,可采取的措施有
A.通入惰性气体 B.升高温度 C.增加CO2浓度 D.增加H2浓度
②下列说法正确的是
A.平衡常数大小:KN<KM
B.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于点M1
C.其他条件不变,加入催化剂可以降低该反应活化能,△H不变
D.当压强或混合气体的密度保持不变时均可证明化学反应已达到平衡状态
③已知M点总压为lMPa,该反应在此温度下的平衡常数Kp=
(3)工业上用CO2和H2反应可合成甲醇(CH3OH)。甲醇燃料电池具有能量转化率高、电量大的特点而被广泛应用,甲醇碱性燃料电池中甲醇加入到
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3,写出得到Na2CO3的离子方程式:
 ):c(
):c( )=
)=
您最近一年使用:0次
2020-09-28更新
|
399次组卷
|
3卷引用:西南名师联盟2021届高考实用性联考卷(二)理科综合化学试题
名校
解题方法
8 . 三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
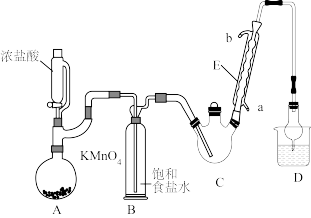
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
(1)仪器E的名称是____________ ,冷凝水的流向是________ 进_______ 出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________ ,引起的后果是_________________ 。
(3)仪器A中发生反应的离子方程式为____________________ 。
(4)该装置C可采用_______________ ,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________ ,装置D烧杯中的试剂是_______________ 。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________ (填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________ 。

查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是
(2)该设计流程中存在一处缺陷,该缺陷是
(3)仪器A中发生反应的离子方程式为
(4)该装置C可采用
(5)装置D干燥管的作用为
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:
您最近一年使用:0次
名校
9 . 下列叙述中不正确的是
A.0.1 mol·L-1 NH4HS溶液中有:c(NH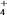 )<c(HS-)+c(S2-)+c(H2S) )<c(HS-)+c(S2-)+c(H2S) |
B.25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH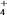 )=c(Cl-),则NH3·H2O的电离常数为 )=c(Cl-),则NH3·H2O的电离常数为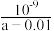 |
| C.等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) |
| D.等PH的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA>HB |
您最近一年使用:0次
2018-03-27更新
|
1277次组卷
|
2卷引用:合肥八中、阜阳一中2017-2018学年第一学期高二年级期末考试化学试题
10 . KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:

(1)请写出镓(与铝同主族的第四周期元素)的原子结构示意图_________ 。
(2)为尽量少引入杂质,试剂①应选用______ (填标号)。理由是______________ 。
A.HCl溶液 B.H2SO4 溶液 C.氨水 D.NaOH溶液
(3)沉淀B的化学式为________ ;将少量明矾溶于水,溶液呈弱酸性,其原因是________ (用离子方程式表示)。
(4)科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为___________________ 。
(5)常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=__________ 。
(6)已知室温下,Kw=10×10-14,Al(OH)3 AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________ 。

(1)请写出镓(与铝同主族的第四周期元素)的原子结构示意图
(2)为尽量少引入杂质,试剂①应选用
A.HCl溶液 B.H2SO4 溶液 C.氨水 D.NaOH溶液
(3)沉淀B的化学式为
(4)科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为
(5)常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=
(6)已知室温下,Kw=10×10-14,Al(OH)3
 AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于
您最近一年使用:0次