1 . 以NaClO为有效成分的“84”消毒液在抗击新冠疫情的消杀工作中起到了重要作用。某研究小组设计下列实验探究NaClO的性质。(已知电离常数:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:Ka=2.9×10-8)
结合上述实验探究,预测的现象以及解释均正确的是
| 实验 | 装置 | 试剂(少量) | 预测可能的现象 |
| ① |  | 酚酞 | 无色溶液最终呈红色 |
| ② | CO2 | 无明显现象 | |
| ③ | 淀粉-KI溶液+稀硫酸 | 无色溶液立即变蓝 | |
| ④ | FeCl3溶液 | 溶液略呈浅绿色 |
| A.实验①:NaClO溶液呈碱性:ClO-+H2O⇌HClO+OH- |
B.实验②:NaClO可用于制得HClO:ClO-+CO2+H2O=2HClO+ |
| C.实验③:NaClO具有氧化性ClO-+2I-+2H+=Cl-+I2+H2O |
D.实验④:NaClO具有还原性:ClO-+4Fe3++2H2O= +4Fe2++4H+ +4Fe2++4H+ |
您最近一年使用:0次
2020-07-11更新
|
394次组卷
|
4卷引用:辽宁省大连市2020届高三第二次模拟考试理科综合化学试题
辽宁省大连市2020届高三第二次模拟考试理科综合化学试题天津市南开区2020届高三第二次模拟考试化学试题(已下线)微专题21 新型含氯化合物的制备与性质探究(ClO2、NOCl等)-备战2022年高考化学考点微专题山东省济北中学2021-2022学年高三上学期11月阶段性检测化学试题
2 . 下列关于常温下的 溶液说法不正确的是
溶液说法不正确的是
资料: 时,
时,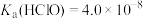 ,
, ,
,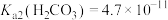
 溶液说法不正确的是
溶液说法不正确的是资料:
 时,
时,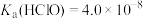 ,
, ,
,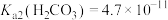
A. 溶液显碱性 溶液显碱性 |
B. 的 的 和 和 的混合溶液中, 的混合溶液中,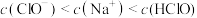 |
C.在酸性条件下可能与 溶液反应产生氯气 溶液反应产生氯气 |
D.与少量 反应的离子方程式为 反应的离子方程式为 |
您最近一年使用:0次
2024-06-03更新
|
251次组卷
|
5卷引用:北京市昌平区2023-2024学年高三下学期二模化学试题
北京市昌平区2023-2024学年高三下学期二模化学试题2024届北京市中关村中学高三下学期化学学科练习(已下线)湖北省十堰市2024届高三下学期第三次模拟化学试题北京市顺义区第一中学2024届高三下学期三模化学试题 北京市中国人民大学附属中学2024届高三下学期化学热身练习(三模)
名校
3 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法并测定相关反应的平衡常数。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I制备消毒液(夹持装置略)
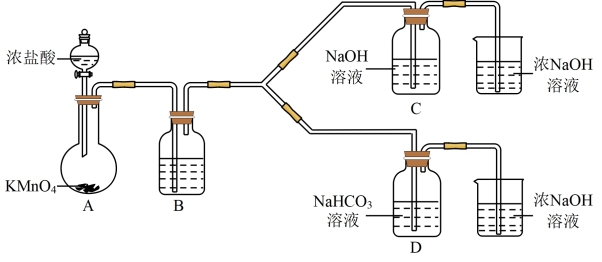
(1)制备NaClO的离子反应方程式___________ 。
(2)结合资料i,写出D中反应的化学方程式___________ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为 。
。
设计实验a证实了假设1成立。NaClO氧化I2生成 的离子方程式是
的离子方程式是___________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是___________ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由___________ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据___________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和
 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。iii.碘单质能与I-反应:I2+I-

 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I制备消毒液(夹持装置略)

(1)制备NaClO的离子反应方程式
(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | |溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体,再加入1mol/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:过量的NaClO将反应生成的I2氧化为
 。
。设计实验a证实了假设1成立。NaClO氧化I2生成
 的离子方程式是
的离子方程式是假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是
(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近一年使用:0次
2022-05-31更新
|
509次组卷
|
3卷引用:北京市第一六六中学2022届高三下学期三模化学试题
名校
解题方法
4 . 三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
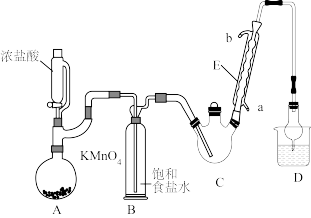
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
(1)仪器E的名称是____________ ,冷凝水的流向是________ 进_______ 出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________ ,引起的后果是_________________ 。
(3)仪器A中发生反应的离子方程式为____________________ 。
(4)该装置C可采用_______________ ,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________ ,装置D烧杯中的试剂是_______________ 。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________ (填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________ 。

查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是
(2)该设计流程中存在一处缺陷,该缺陷是
(3)仪器A中发生反应的离子方程式为
(4)该装置C可采用
(5)装置D干燥管的作用为
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:
您最近一年使用:0次
名校
解题方法
5 . 为探究某些硫的含氧酸盐的部分性质,进行如下实验,并记录实验现象。①测量0.01 mol/LNaHSO3溶液的pH,pH约为5;②向0.01 mol/LNaHSO3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液的紫红色褪去;③向0.1 mol/LNa2S2O3溶液中滴加稀盐酸,产生无色有刺激性气味的气体,且出现淡黄色沉淀,经测定溶液中无 ;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是
;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是
 ;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是
;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是A.实验①说明: |
B.实验②中发生反应: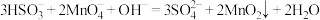 |
| C.实验③中的淡黄色沉淀为S,无色有刺激性气味的气体为H2S |
D.实验④说明:该条件下, 的氧化性强于 的氧化性强于 |
您最近一年使用:0次
2022-05-27更新
|
652次组卷
|
12卷引用:江苏省启东中学2022届高三最后一考化学试题
江苏省启东中学2022届高三最后一考化学试题江苏扬州市2021届高三1月调研考试化学试题江苏省扬州市2021届高三上学期检测化学试题(已下线)2021年秋季高三开学摸底考化学试卷03(江苏专用)江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期第一次阶段性诊断测试化学试题江苏省响水中学2022-2023学年高三上学期开学测试化学试题江苏省扬州市2022届高三下学期5月考前调研测试化学(B)试题江苏省南京市雨花台中学2022-2023学年高二上学期10月月考化学试题江苏省泰州中学2022-2023学年高二5月检测化学试题江苏省常州市八校2022-2023学年高三上学期10月联合调研化学试题江苏省盐城市联盟校2023-2024学年高三上学期10月第一次学情调研检测化学试卷江苏省宿迁市青华中学2023-2024学年高三上学期期中考试化学试题
2010·宁夏银川·一模
6 . 运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是___________ (填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式___________ 。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为___________ ;若CO能够与Na2O2发生反应,则预测反应产物为___________ 。实验后用球形干燥管中的固体进行验证可选择的试剂是___________ 。
(4)已知C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;CO(g)+ O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式___________ 。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为___________ 。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)___________ L。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4
 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为(4)已知C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;CO(g)+
 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
您最近一年使用:0次
7 . 乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s) H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________ (填标号)。
A.压强不再变化 B. CO2(g)的体积分数保持不变
C. 混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:
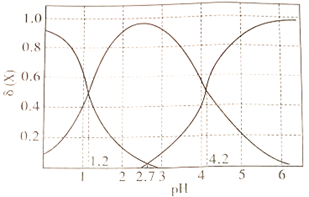
①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________ (填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4- 2HC2O4-的平衡常数的对数值1gK=
2HC2O4-的平衡常数的对数值1gK=____________ 。
(3)向10 mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)____________ 10 mL(填“>”“=”或“<”)。
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是____________ ; 该过程中发生反应的离子方程式为____________ ;滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为____________ 。
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)
 H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是A.压强不再变化 B. CO2(g)的体积分数保持不变
C. 混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:

①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4-
 2HC2O4-的平衡常数的对数值1gK=
2HC2O4-的平衡常数的对数值1gK=(3)向10 mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是
您最近一年使用:0次
名校
8 . C1O2作为一种强氧化剂,是国际上公认的高效消毒灭菌剂,但因其易爆有毒,常用NaClO2替代。常温下,将NaOH固体加入到由0.1molC1O2溶于水配成的1L溶液中。溶液pH及部分组分含量变化曲线如图,下列叙述不正确的是
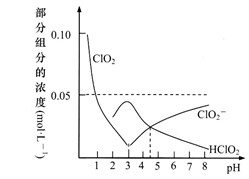
(已知:2C1O2+H2O HClO2+H++C1O3-)
HClO2+H++C1O3-)

(已知:2C1O2+H2O
 HClO2+H++C1O3-)
HClO2+H++C1O3-)| A.Ka(HClO2)≈10-4.5 |
| B.不能用pH试纸测该溶液的pH |
| C.酸性:HClO2<HClO3,氧化性:HClO2>HClO3 |
| D.该图象上任何一点,都有c(C1O2-)+c(HClO2)+c(C1O3-)=0.1mol·L-1 |
您最近一年使用:0次
2018-05-17更新
|
1159次组卷
|
8卷引用:【全国市级联考】山东省青岛市2018届高三5月第二次模拟检测理综化学试题
名校
9 . 我国核电技术居于世界前列。从铀矿石中提取核燃料的过程中,UO3可用酸性浸出剂或碱性浸出剂转化成铀氧基离子UO22+的化合物。

(1)写出硫酸酸浸时的化学方程式__________________________ ,为了提高浸出率,可采取的措施是__________________ (写两条)。
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式__________________ ,__________________ 。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,此时Fe3+的物质的量浓度范围相当于______________ 。
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式_________________________________ 。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_________________________ 。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含Mn2+为0.0020 mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L―1时,Mn2+开始沉淀,则a=__________ 。[已知:Ksp(MnS)=1.4×10-15]

(1)写出硫酸酸浸时的化学方程式
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为
您最近一年使用:0次
解题方法
10 . 连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4)易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I.锌粉法、II.甲酸钠法。
I.实验室模拟锌粉法的装置如图(加热等辅助仪器略去)

反应原理为:
Zn+2SO2=ZnS2O4
ZnS2O4+2NaOH=Zn(OH)2↓+Na2S2O4
(1)连接好装置后,首先要检验装置的气密性,方法为___ 。
(2)①装置A中分液漏斗中的试剂是___ 。
A.稀硫酸 B.98%的硫酸 C.70%的硫酸
②装置B中反应结束后,取出混合物进行以下操作,得到Na2S2O4晶体。
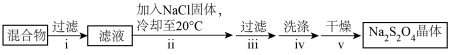
操作ii加入NaCl固体的目的是__ (用平衡移动原理解释),操作iv洗涤中选用的试剂是__ (填“水”或“甲醇”)。
(3)实验室保存新制Na2S2O4晶体的方法是___ 。
II.实验室模拟甲酸钠法的装置如图(加热等辅助仪器略去)

第一步,在F装置中加入甲酸钠、氢氧化钠、甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体:
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F的名称___ ,在其中制备连二亚硫酸钠的离子方程式可表示为___ 。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1ˊ≈4.4×10-7,K2ˊ≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO 、SO
、SO 离子浓度相等时,溶液的pH约为
离子浓度相等时,溶液的pH约为___ 。
(6)甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___ 。
I.实验室模拟锌粉法的装置如图(加热等辅助仪器略去)

反应原理为:
Zn+2SO2=ZnS2O4
ZnS2O4+2NaOH=Zn(OH)2↓+Na2S2O4
(1)连接好装置后,首先要检验装置的气密性,方法为
(2)①装置A中分液漏斗中的试剂是
A.稀硫酸 B.98%的硫酸 C.70%的硫酸
②装置B中反应结束后,取出混合物进行以下操作,得到Na2S2O4晶体。

操作ii加入NaCl固体的目的是
(3)实验室保存新制Na2S2O4晶体的方法是
II.实验室模拟甲酸钠法的装置如图(加热等辅助仪器略去)

第一步,在F装置中加入甲酸钠、氢氧化钠、甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体:
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F的名称
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1ˊ≈4.4×10-7,K2ˊ≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO
 、SO
、SO 离子浓度相等时,溶液的pH约为
离子浓度相等时,溶液的pH约为(6)甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于
您最近一年使用:0次



