解题方法
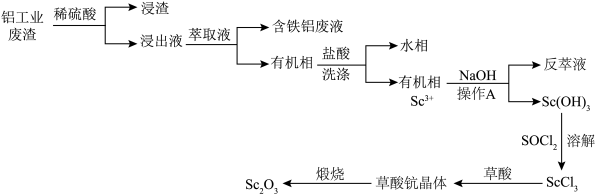
1 . 钪(Sc)可用于制造特种玻璃、轻质耐高温合金及半导体器件等,在航天,航空、核反应、医疗等方面有广泛应用。以制铝工业提取氧化铝时排出的废渣(含有Se2O3,Al2O3、Fe2O3、SiO2等)为原料提取氧化钪(Sc2O3)的流程如下:
②25℃时,Ka1(H2C2O4)=5.0×10-2、Ka2(H2C2O4)=5.0×10-5。
回答下列问题:
(1)废渣酸浸时,为了提高浸出率,可采取的措施有___________ (任写两条);浸渣的主要用途有___________ 。
(2)“萃取”时选用酸性磷酸酯(P507)为主的复合萃取剂,其中P507的质量分数(ω)对萃取率的影响如图1所示,料液温度对分离系数[分离系数指分离后混合体系中某物质的物质的量分数,如βSc/Fe= ×100%]的影响如图2所示:
×100%]的影响如图2所示:___________ ,料液的最适合温度为___________ 。
(3)一般认为c≤1.0×10-5mol/L时沉淀完全,已知lg2≈0.3,反萃取时,为了让Sc3+沉淀完全,应控制溶液pH的最小值为___________ 。
(4)在实验室中完成操作A和煅烧草酸钪晶体,所需装置分别为___________ (填字母)。___________ 。
(6)25℃时,pH=2的草酸溶液中 =
=___________ 。
②25℃时,Ka1(H2C2O4)=5.0×10-2、Ka2(H2C2O4)=5.0×10-5。
回答下列问题:
(1)废渣酸浸时,为了提高浸出率,可采取的措施有
(2)“萃取”时选用酸性磷酸酯(P507)为主的复合萃取剂,其中P507的质量分数(ω)对萃取率的影响如图1所示,料液温度对分离系数[分离系数指分离后混合体系中某物质的物质的量分数,如βSc/Fe=
 ×100%]的影响如图2所示:
×100%]的影响如图2所示:
(3)一般认为c≤1.0×10-5mol/L时沉淀完全,已知lg2≈0.3,反萃取时,为了让Sc3+沉淀完全,应控制溶液pH的最小值为
(4)在实验室中完成操作A和煅烧草酸钪晶体,所需装置分别为
(6)25℃时,pH=2的草酸溶液中
 =
=
您最近一年使用:0次
2 . 钪的特殊性质,使其在电子工业、航天、核技术、激光技术、冶金、化工、医学、农业等各方面得到广泛应用。一种利用高温沸腾氯化烟尘(主要成分为AlCl3、FeCl3、TiCl4、ScCl3等,还含有其他难溶于酸的物质)回收Sc的工艺流程如图。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为_______ mL,需要使用的玻璃仪器除烧杯、量筒、玻璃棒外,还需要的是_______ 。
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为_______ 。
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:_______ 。
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中 =
=_______ 。(25°C时,草酸的电离平衡常数为Ka1=5.0×10-2,Ka2=5.4×10-5)
(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:_______ 。
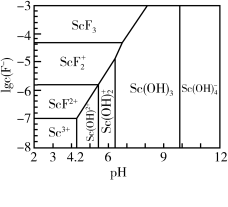
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为_______ (填化学式)。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中
 =
=(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为

您最近一年使用:0次
解题方法
3 . 室温下某二元弱酸 的各含
的各含 微粒分布系数如图所示。向
微粒分布系数如图所示。向 溶液中滴加
溶液中滴加 溶液。一般认为二元弱酸
溶液。一般认为二元弱酸 能被分步准确滴定的条件是
能被分步准确滴定的条件是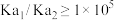 。下列说法错误的是
。下列说法错误的是
 的各含
的各含 微粒分布系数如图所示。向
微粒分布系数如图所示。向 溶液中滴加
溶液中滴加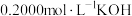 溶液。一般认为二元弱酸
溶液。一般认为二元弱酸 能被分步准确滴定的条件是
能被分步准确滴定的条件是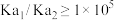 。下列说法错误的是
。下列说法错误的是
A.滴定开始时溶液 约为1.1 约为1.1 |
B.滴入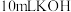 溶液时,混合体系中 溶液时,混合体系中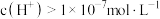 |
C.滴定理论终点时,溶液中存在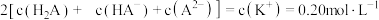 |
D.借助指示剂甲基橙和酚酞,用 标准溶液可测定 标准溶液可测定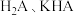 混合液中的KHA含量 混合液中的KHA含量 |
您最近一年使用:0次
4 . 硫酸锌广泛用于涂料、皮革等行业。工业上用锌白矿(主要成分为ZnO,还含有PbO、FeO、Fe2O3、CuO 、SiO2等杂质)制备硫酸锌的流程如图:

已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:

②相关常数:Ksp(ZnS)=2.1 ×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15, Ka(CH3COOH)=1.8×10-5。
回答下列问题:
(1)滤渣1的主要成分为_______ 、_______ 。
(2)“沉铜”操作时添加的物质A可以是Zn或Fe。与使用Zn相比,使用Fe的不足之处是_______ 。
(3)加入物质B调节pH。下列物质中,不能作为物质B使用的是_______ (填选项);滤渣3中除物质B外,还含有的主要物质是_______ 。
A.ZnO B.ZnCO3 C.Zn(OH)2 D.Zn5(OH)8Cl2·H2O
(4)调节“滤液3”pH值的范围是9.5~_______ 。
(5)滤液4经过加热蒸发、冷却结晶 等操作得到硫酸锌晶体,其中不同降温方式的冷却结晶得到晶体的颗粒大小及其质量分数如图所示。如果需要得到较小的硫酸锌晶粒,宜选用
等操作得到硫酸锌晶体,其中不同降温方式的冷却结晶得到晶体的颗粒大小及其质量分数如图所示。如果需要得到较小的硫酸锌晶粒,宜选用_______ 的方式进行降温结晶。

(6)滤液4经一系列操作后制得ZnSO4·7H2O,最终残留的酸性废液中含有ZnSO4。除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
则:处理后的溶液pH=_______ ,溶液中 c(Zn2+)=_______ mol·L-1。

已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:

②相关常数:Ksp(ZnS)=2.1 ×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15, Ka(CH3COOH)=1.8×10-5。
回答下列问题:
(1)滤渣1的主要成分为
(2)“沉铜”操作时添加的物质A可以是Zn或Fe。与使用Zn相比,使用Fe的不足之处是
(3)加入物质B调节pH。下列物质中,不能作为物质B使用的是
A.ZnO B.ZnCO3 C.Zn(OH)2 D.Zn5(OH)8Cl2·H2O
(4)调节“滤液3”pH值的范围是9.5~
(5)滤液4经过加热蒸发、冷却结晶
 等操作得到硫酸锌晶体,其中不同降温方式的冷却结晶得到晶体的颗粒大小及其质量分数如图所示。如果需要得到较小的硫酸锌晶粒,宜选用
等操作得到硫酸锌晶体,其中不同降温方式的冷却结晶得到晶体的颗粒大小及其质量分数如图所示。如果需要得到较小的硫酸锌晶粒,宜选用
(6)滤液4经一系列操作后制得ZnSO4·7H2O,最终残留的酸性废液中含有ZnSO4。除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度(mol·L-1) | 0.10 | 0.10 | 0.18 |
则:处理后的溶液pH=
您最近一年使用:0次
名校
解题方法
5 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径、CO、捕获与CO2重整是CO2利用的研究热点,
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
则 △H=
△H=________ kJ∙mol−1。
(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:_____ T2(填“>”“<”或“=”),依据为________ ;
②图中a=________ ;
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为________ 。
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为___________ (写离子符号);若所得溶液

 溶液pH=
溶液pH=_____ (室温下,
 的
的
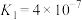 ;
;
 )。
)。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是___________ 。
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
| 共价键 | C=O | C-O | H-H | H-O | C-H |
| 键能/(kJ·mol⁻¹) | 799 | 343 | 436 | 463 | 413 |
 △H=
△H=(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:
②图中a=
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为

 溶液pH=
溶液pH= 的
的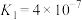 ;
; )。
)。(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是
您最近一年使用:0次
2023-10-29更新
|
375次组卷
|
2卷引用:内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题
6 . 磷锌白[Zn3(PO4)2]可用于生产无毒防锈颜料和水溶性涂料。一种利用烧铸灰(主要含ZnO,还含少量Fe3O4、PbO、SnO2、CuO及SiO2等)为原料制取磷锌白的工艺流程如下图所示:

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有_______ (列举1条),“滤渣1”的主要成分为_______ (填化学式)。
(2)写出“沉锰”步骤的离子方程式:_______ 。
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
“调pH”为4.0的目的是除去Fe3+和_______ ,为检验“过滤2”后的滤液中是否含有Fe3+,可选用的化学试剂是_______ 。
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为_______ 。
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为_______ 。[已知:25℃,H2S溶于水形成饱和溶液时,c(H2S) = 0.1 mol/L;H2S的电离平衡常数Ka1 = 1×10−7,Ka2 = 1×10−13;Ksp(CuS) = 6×10−36]
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为_______ (保留三位有效数字)。

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有
(2)写出“沉锰”步骤的离子方程式:
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
| 金属离子 | Sn4+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 0.5 | 2.2 | 4.8 | 6.5 |
| 沉淀完全的pH | 1.3 | 3.6 | 6.4 | 8.5 |
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为
您最近一年使用:0次
7 . 甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图,下列说法错误 的是


| A.该回收利用的原理是R3N粒子对HCOO-的静电吸附 |
| B.pH=5的废水中c(HCOO-):c(HCOOH)=18:1,则甲酸电离平衡常数K的数量级为10-4 |
| C.废水初始2.4<pH<5时,随pH上升回收率下降的原因是离子交换树脂活性成分R3NH+含量下降 |
| D.废水初始pH<2.4时,甲酸的电离程度对回收率影响显著 |
您最近一年使用:0次
名校
8 . 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。常温下,利用盐酸滴定某溶液中亚磷酸钠 的含量,其电位滴定曲线与
的含量,其电位滴定曲线与 曲线如图所示。下列说法正确的是
曲线如图所示。下列说法正确的是

已知:亚磷酸 是二元弱酸,电离常数
是二元弱酸,电离常数 ,
,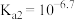 。
。
 的含量,其电位滴定曲线与
的含量,其电位滴定曲线与 曲线如图所示。下列说法正确的是
曲线如图所示。下列说法正确的是
已知:亚磷酸
 是二元弱酸,电离常数
是二元弱酸,电离常数 ,
,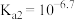 。
。| A.a点对应的溶液呈弱碱性 |
| B.水的电离程度:a点小于b点 |
C.a点对应的溶液中存在: |
D.b点对应的溶液中存在: |
您最近一年使用:0次
2022-05-09更新
|
429次组卷
|
3卷引用:福建省莆田市2022届高三下学期第三次质量检测化学试题
名校
解题方法
9 . 亚氯酸钠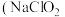 )在溶液中会生成
)在溶液中会生成 、
、 、
、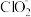 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
 )在溶液中会生成
)在溶液中会生成 、
、 、
、 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
A. 的电离平衡常数的数值 的电离平衡常数的数值 |
B. 时, 时,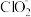 部分转化成 部分转化成 和 和 离子的方程式为: 离子的方程式为: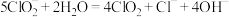 |
C. 时,溶液中含氯微粒的浓度大小为: 时,溶液中含氯微粒的浓度大小为: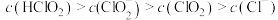 |
D.同浓度 溶液和 溶液和 溶液等体积混合,则混合溶液中有: 溶液等体积混合,则混合溶液中有: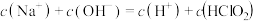 |
您最近一年使用:0次
2022-11-02更新
|
416次组卷
|
9卷引用:四川省遂宁市2018届高三第一次诊断考试理综化学试题
四川省遂宁市2018届高三第一次诊断考试理综化学试题【全国百强校】四川省棠湖中学2019届高三二诊模拟理综-化学试题辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题【全国百强校】四川省棠湖中学2019届高三下学期4月月考理科综合化学试题四川省泸县第四中学2018-2019学年高二下学期下学期期中考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——电解质溶液中的曲线分析【精编23题】天津市耀华中学2022-2023学年高二上学期期中调研化学试题山东省济南大学城实验高中2021-2022学年高三3月阶段性调研化学试题河南省南阳市第一中学校2022-2023学年高三上学期12月月考化学试题
10 . 乙二胺(H2NCH2CH2NH2)是二元弱碱,H2A是二元弱酸。下图既可表示常温下乙二胺溶液中含氮微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线,又可表示常温下H2A溶液中H2A、HA-、A2-微粒的百分含量δ随溶液pH的变化曲线。
已知:H2NCH2CH2NH2+H2O⇌[H2NCH2CH2NH3]++OH-

下列说法正确的是
已知:H2NCH2CH2NH2+H2O⇌[H2NCH2CH2NH3]++OH-

下列说法正确的是
| A.曲线c表示H2NCH2CH2NH2或H2A的百分含量δ随溶液pH的变化情况 |
B.乙二胺的 |
| C.一定浓度的[H3NCH2CH2NH3]Cl2溶液中存在关系式:2c([H2NCH2CH2NH2])+c([H3NCH2CH2NH2]+)=c(H+)-c(OH-) |
| D.[H3NCH2CH2NH2][HA]溶液中各离子浓度大小关系为:c([H3NCH2CH2NH2]+)=c(HA-)>c(H2NCH2CH2NH2)=c(A2-)>c(H+)=c(OH-) |
您最近一年使用:0次
2022-06-02更新
|
345次组卷
|
6卷引用:江西省八所重点中学2020-2021学年高三下学期4月联考理综化学试题
江西省八所重点中学2020-2021学年高三下学期4月联考理综化学试题四川省遂宁市2021届高三第三次诊断性考试理综化学试题四川省泸县第一中学2022届高三三诊模拟考试理科综合化学试题四川省泸州市泸县第四中学2022届高三高考适应性考试理综化学试题(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(新高考)江西省九江市九江第一中学2022-2023学年高二上学期期中考试化学试题



