1 . 已知磷酸(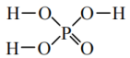 )与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是
)与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是
 )与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是
)与NaOH反应生成的正盐为Na3PO4,次磷酸(H3PO2)与NaOH反应生成的正盐为NaH2PO2。下列说法不正确的是| A.H3PO2属于一元酸 |
| B.NaH2PO2溶液可能呈酸性 |
| C.H3PO2可能既有氧化性又有还原性 |
D.H3PO2的结构式为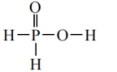 |
您最近一年使用:0次
名校
2 . 已知酸性:H2CO3>HClO>HCO ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是
 ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是A.向含有相等物质的量的HCO 、ClO-、CO 、ClO-、CO 溶液中,逐滴加入稀盐酸,反应由前到后顺序为:HCO 溶液中,逐滴加入稀盐酸,反应由前到后顺序为:HCO 、ClO-、CO 、ClO-、CO |
| B.向含有0.4molFeI2的溶液中通入0.3molCl2充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2 |
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO |
| D.向FeBr2溶液中滴加少量氯水,再加入CCl4溶液振荡,静置,有机层呈橙色 |
您最近一年使用:0次
名校
3 . 已知在 时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
(1)写出亚硫酸的第一步电离平衡常数表达式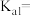
_______ 。
(2)在相同条件下, 、
、 、
、 和
和 结合
结合 的能力由弱到强的顺序是
的能力由弱到强的顺序是_______ 。
(3)若保持温度不变,在醋酸溶液中通入少量 气体,下列量会变小的是
气体,下列量会变小的是_______ (填字母序号,下同)。
a. b.
b. c.醋酸的电离平衡常数
c.醋酸的电离平衡常数
(4)下列离子方程式中正确的是的是_______ 。
A.少量 通入次氯酸钠溶液中:
通入次氯酸钠溶液中:
B.少量 通入次氯酸钙溶液中:
通入次氯酸钙溶液中: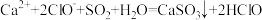
C.过量 通入氢氧化钠溶液中:
通入氢氧化钠溶液中:
 时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为:| 醋酸 |  | 次氯酸 | 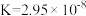 |
| 碳酸 | 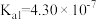 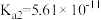 | 亚硫酸 | 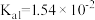 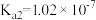 |
(1)写出亚硫酸的第一步电离平衡常数表达式
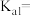
(2)在相同条件下,
 、
、 、
、 和
和 结合
结合 的能力由弱到强的顺序是
的能力由弱到强的顺序是(3)若保持温度不变,在醋酸溶液中通入少量
 气体,下列量会变小的是
气体,下列量会变小的是a.
 b.
b. c.醋酸的电离平衡常数
c.醋酸的电离平衡常数(4)下列离子方程式中正确的是的是
A.少量
 通入次氯酸钠溶液中:
通入次氯酸钠溶液中:
B.少量
 通入次氯酸钙溶液中:
通入次氯酸钙溶液中: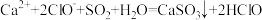
C.过量
 通入氢氧化钠溶液中:
通入氢氧化钠溶液中:
您最近一年使用:0次
4 . 部分弱酸的电离平衡常数如下表,根据表中数据下列方程式一定错误的是
| 酸 | 电离方程式 | 电离平衡常数K |
 | 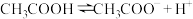 |  |
 | 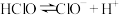 |  |
 |   | 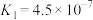  |
 |   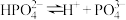 | 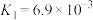 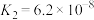  |
A. |
B. |
C. |
D.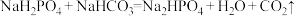 |
您最近一年使用:0次
5 . 某兴趣小组的同学向一定体积的 溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是
溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是

 溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是
溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是
A.AB段溶液的导电能力不断减弱,说明生成的 不是电解质 不是电解质 |
B.B处溶液的导电能力为0,说明 不是电解质 不是电解质 |
C.a时刻 溶液与稀硫酸恰好完全中和, 溶液与稀硫酸恰好完全中和, 与 与 已完全沉淀 已完全沉淀 |
D.BC段溶液的导电能力不断增大,主要是由于过量的 电离出的离子导电 电离出的离子导电 |
您最近一年使用:0次
2021-07-12更新
|
670次组卷
|
3卷引用:广东省广州市五校2020-2021学年高一下学期期末联考化学试题
广东省广州市五校2020-2021学年高一下学期期末联考化学试题(已下线)必考点04 弱电解质的电离-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版) 【定心卷】3.1.2 弱电解质的电离平衡随堂练习-人教版2023-2024学年选择性必修1
名校
6 . 常温下,已知:一元弱酸(HR)的Ka=2.95×10-8,二元弱酸(H2M)的Ka1=4.3×10-7、Ka2=5.6×10-11。下列说法正确的是
| A.0.1 mol·L-1的NaHM溶液显碱性 |
| B.等浓度的NaR溶液与NaHM溶液相比,前者pH小 |
| C.向NaR溶液中加入少量H2M,发生反应的离子方程式为2R-+H2M=2HR+M2- |
| D.pH相等的HR溶液和H2M溶液分别与相同的NaOH溶液反应,消耗的NaOH溶液体积相等 |
您最近一年使用:0次
2021-06-10更新
|
127次组卷
|
3卷引用:山西省晋城市高平一中、阳城一中、高平一中实验学校2020-2021学年高二下学期期中联考化学试题
名校
解题方法
7 . 已知人体体液中存在维持体液pH相对稳定的平衡: CO2+ H2O H2CO3
H2CO3 H++
H++ ,则下列说法不合理的是
,则下列说法不合理的是
 H2CO3
H2CO3 H++
H++ ,则下列说法不合理的是
,则下列说法不合理的是| A.当人体体内的酸碱平衡失调时,血液的pH是诊断疾病的一个重要参数 |
| B.如果CO2进入体液,会使体液的pH减小 |
| C.当强酸性物质进入体液后,平衡向左移动 |
| D.静脉滴注生理盐水,体液的pH会有大幅改变 |
您最近一年使用:0次
2021-05-22更新
|
656次组卷
|
5卷引用:河北省石家庄第二中学2020-2021学年高二上学期期中考试化学试题
河北省石家庄第二中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期中考试化学试题吉林省长春市北师大附属学校2021-2022学年高二上学期期末考试化学试题(已下线)第17讲 溶液的酸碱性与pH的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)第三章 第二节 水的电离和溶液的pH 第1课时 水的电离 溶液的酸碱性与pH
20-21高三上·全国·阶段练习
8 . 煤的综合利用包括煤的干馏、气化、液化等。煤的气化用于生产各种气体燃料,有利于环境保护和提高煤的利用效率;煤的液化产品将替代目前的石油,最常见的液化方法是用煤生产CH3OH,对优化终端能源结构具有重要的战略意义。
(1)煤的直接甲烷化反应为C(s)+2H2(g) CH4(g) ΔH,在不同含金催化剂条件下的反应历程如下图所示:
CH4(g) ΔH,在不同含金催化剂条件下的反应历程如下图所示:
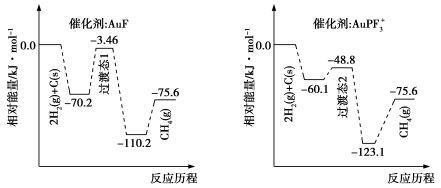
催化煤的直接甲烷化效果较好的催化剂是___ (填“AuF”或“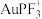 ”),该反应在
”),该反应在__________ (填“高温”或“低温”)下能自发进行。
(2)煤的液化可以合成甲醇。已知:
“气化”:C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol−1
催化液化I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=−49.0 kJ·mol−1
催化液化II:CO2(g)+2H2(g)=CH3OH(g)+ O2(g) ΔH3=m kJ·mol−1
O2(g) ΔH3=m kJ·mol−1
①则反应C(s)+H2O(g)+H2(g)=CH3OH(g) ∆H=______ kJ·mol−1。
②一定温度下,以水煤气为原料合成甲醇反应CO(g)+2H2(g) CH3OH(g)的平衡常数数值Kp=4.80×10−2 kPa−2,向容器中充入2 mol H2和1 mol CO,反应达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为
CH3OH(g)的平衡常数数值Kp=4.80×10−2 kPa−2,向容器中充入2 mol H2和1 mol CO,反应达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为___________ (结果保留3位有效数字,Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫的方法有多种,方法之一是用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。已知常温下亚硫酸的电离常数Ka1=1.5×10−2,Ka2=1.0×10−7,一水合氨的电离常数Kb=1.8×10−7。
①关于NH4HSO3溶液,下列说法正确的是________ (填字母标号)。
a.NH4HSO3溶液呈酸性是因为NH4HSO3= +H+ +
+H+ +
b.NH4HSO3溶液中c( )+c(H+)=c(
)+c(H+)=c( )+2c(
)+2c( )+c(OH−)
)+c(OH−)
c.NH4HSO3溶液中c( )=c(
)=c( )+c(
)+c( )+c(H2SO3)
)+c(H2SO3)
d.NH4HSO3溶液中c( )>c(
)>c( )>c(H2SO3)>c(
)>c(H2SO3)>c( )
)
②向NH4HSO3溶液中通入空气,发生反应的离子方程式为___________ 。
③常温下,若溶液中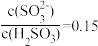 时,溶液的pH=
时,溶液的pH=________ 。
(1)煤的直接甲烷化反应为C(s)+2H2(g)
 CH4(g) ΔH,在不同含金催化剂条件下的反应历程如下图所示:
CH4(g) ΔH,在不同含金催化剂条件下的反应历程如下图所示:
催化煤的直接甲烷化效果较好的催化剂是
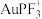 ”),该反应在
”),该反应在(2)煤的液化可以合成甲醇。已知:
“气化”:C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol−1
催化液化I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=−49.0 kJ·mol−1
催化液化II:CO2(g)+2H2(g)=CH3OH(g)+
 O2(g) ΔH3=m kJ·mol−1
O2(g) ΔH3=m kJ·mol−1 ①则反应C(s)+H2O(g)+H2(g)=CH3OH(g) ∆H=
②一定温度下,以水煤气为原料合成甲醇反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数数值Kp=4.80×10−2 kPa−2,向容器中充入2 mol H2和1 mol CO,反应达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为
CH3OH(g)的平衡常数数值Kp=4.80×10−2 kPa−2,向容器中充入2 mol H2和1 mol CO,反应达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为(3)燃煤烟气脱硫的方法有多种,方法之一是用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。已知常温下亚硫酸的电离常数Ka1=1.5×10−2,Ka2=1.0×10−7,一水合氨的电离常数Kb=1.8×10−7。
①关于NH4HSO3溶液,下列说法正确的是
a.NH4HSO3溶液呈酸性是因为NH4HSO3=
 +H+ +
+H+ +
b.NH4HSO3溶液中c(
 )+c(H+)=c(
)+c(H+)=c( )+2c(
)+2c( )+c(OH−)
)+c(OH−)c.NH4HSO3溶液中c(
 )=c(
)=c( )+c(
)+c( )+c(H2SO3)
)+c(H2SO3)d.NH4HSO3溶液中c(
 )>c(
)>c( )>c(H2SO3)>c(
)>c(H2SO3)>c( )
)②向NH4HSO3溶液中通入空气,发生反应的离子方程式为
③常温下,若溶液中
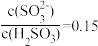 时,溶液的pH=
时,溶液的pH=
您最近一年使用:0次
名校
解题方法
9 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 | X溶液中一定含有Fe2+ |
| B | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Br2的氧化性比I2的强 |
| D | 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 | HNO2电离出H+的能力比CH3COOH的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 下表为元素周期表的一部分。回答下列问题:
(1)表中元素原子半径最小的是(写元素符号)_______ 。
(2)Y元素在周期表中的位置为_______ 。
(3)硫的气态氢化物的电子式为_______ ,其水溶液在空气中放置易变浑浊,该变化说明硫的非金属性比氧_______ (填“强”或“弱”)
(4)25℃,两种酸的电离平衡常数如下表。
①HSO 的电离平衡常数表达式K=
的电离平衡常数表达式K=_______ 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______ 。
| 碳 | 氮 | Y | M |
| X | 硫 | Z |
(1)表中元素原子半径最小的是(写元素符号)
(2)Y元素在周期表中的位置为
(3)硫的气态氢化物的电子式为
(4)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO
 的电离平衡常数表达式K=
的电离平衡常数表达式K=②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次



