1 . 现有室温下浓度均为1×10-3mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氨水、⑤NaOH溶液。回答下列问题:
(1)上述5种溶液中,水电离出的c(H+)最小的是_______ 。(填序号,下同)
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________ ,最终产生H2总量的关系为________ 。
(3)若将等体积的④、⑤溶液加热至相同温度后,溶液的pH大小关系为④________ ⑤。(填“>”、“<”、“=”)
(4)在25℃时,某Na2SO4溶液中c( )=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=___________ 。
(5)t℃时,水的离子积为1×10-12,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=________ 。
(6)泡沫灭火器中装有硫酸铝和碳酸氢钠溶液,二者混合时发生剧烈反应,请写出灭火时发生反应的离子方程式___________ 。利用纯碱溶液的碱性可以去除油污,呈碱性的原因是(填离子方程式)______
(1)上述5种溶液中,水电离出的c(H+)最小的是
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为
(3)若将等体积的④、⑤溶液加热至相同温度后,溶液的pH大小关系为④
(4)在25℃时,某Na2SO4溶液中c(
 )=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=(5)t℃时,水的离子积为1×10-12,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=
(6)泡沫灭火器中装有硫酸铝和碳酸氢钠溶液,二者混合时发生剧烈反应,请写出灭火时发生反应的离子方程式
您最近一年使用:0次
2 . 已知碳酸、亚硫酸、次氯酸的平衡常数如表,下列说法正确的是
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10−7 | K1=1.54×10−2 | K=2.95×10−8 |
| K2=5.61×10−11 | K2=1.02×10−7 |
| A.相同条件下,同浓度的H2SO3溶液和H2CO3溶液的酸性,后者更强 |
B.Na2CO3溶液中通少量SO2:2CO +SO2+H2O=2HCO +SO2+H2O=2HCO +SO +SO |
C.NaHCO3溶液中通少量SO2:HCO +SO2=CO2+HSO +SO2=CO2+HSO |
| D.向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
您最近一年使用:0次
20-21高二上·全国·假期作业
3 . 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数(25 ℃),若已知下列反应可以发生:NaCN+HNO2=HCN+NaNO2、NaCN+HF=HCN+NaF、NaNO2+HF=HNO2+NaF。由此可判断下列叙述中不正确的是
| A.K(HF)=7.2×10-4 |
| B.K(HNO2)=4.9×10-10 |
| C.根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN |
| D.K(HCN)<K(HNO2)<K(HF) |
您最近一年使用:0次
2021-01-14更新
|
399次组卷
|
7卷引用:练习9 弱电解质的电离平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)
(已下线)练习9 弱电解质的电离平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)广西梧州市蒙山中学2020-2021学年高二下学期4月月考化学试题(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)甘肃省嘉峪关市第一中学2020-2021学年高二下学期期中考试化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高二上学期期末考试化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高二上学期第一次月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第46练 弱电解质的电离平衡
4 . 在室温下,将少量二氧化碳通入NaCN溶液中,发生如下反应:CO2+H2O+CN- =HCO +HCN。以下说法正确的是
+HCN。以下说法正确的是
 +HCN。以下说法正确的是
+HCN。以下说法正确的是| A.电离常数:K(HCN) < Ka2 (H2CO3) |
| B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN < NaHCO3 |
| C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等 |
| D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等 |
您最近一年使用:0次
名校
5 . 运用电离平衡常数判断可以发生的反应是( )
①HBrO+Na2CO3=NaBrO+NaHCO3
②2HBrO+Na2CO3=2NaBrO+H2O+CO2↑
③HBrO+NaHCO3=NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O=NaHCO3+HBrO
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
| 次溴酸 | Ka=2.4×10-9 |
②2HBrO+Na2CO3=2NaBrO+H2O+CO2↑
③HBrO+NaHCO3=NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O=NaHCO3+HBrO
| A.①③ | B.②④ | C.①④ | D.②③ |
您最近一年使用:0次
2021-01-04更新
|
393次组卷
|
5卷引用:甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题
甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题新疆伊犁奎屯市第一高级中学2020-2021学年高二上学期期末考试化学试题安徽省安庆桐城市第八中学2019-2020学年高二上学期第二次月考化学试题(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)第1讲 弱电解质的电离平衡
名校
6 . 磷是重要的元素,能形成多种含氧酸。回答下列问题:
(1)次磷酸(H3PO2)是一元酸,其电离常数的值K=9×103。向10 mL0.1 mol•L-1H3PO2溶液中加入30 mL等物质的量浓度的NaOH溶液,写出反应的离子方程式____________ ,c(Na+)+c(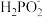 )+c(H3PO2)=
)+c(H3PO2)=_______________ (忽略混合后溶液体积的变化)。
(2)亚磷酸(H3PO3)是二元弱酸, 25℃时亚磷酸的电离常数的值为K1=1×10-2、
K2=2.6×10-7,则NaH2PO3溶液显性_____ (填“酸”“碱”或“中”),原因是________ (结合化学用语及数据计算进行解释)。
(3)已知HF的电离常数的值为K=3.6×10-4,将足量HF溶液和Na2HPO3溶液反应,其离子方程式为_______________________ 。
(4)亚磷酸具有强还原性。化学实验小组利用滴定法测定某亚磷酸溶液浓度,某25.00 mL的亚磷酸溶液放入锥形瓶中,用0.10 mol•L-1的高锰酸钾溶液进行滴定,反应的离子方程式是5H3PO3+2 +6H+=5H3PO4+2Mn2++3H2O。三次滴定实验的数据分别如下:
+6H+=5H3PO4+2Mn2++3H2O。三次滴定实验的数据分别如下:
①亚磷酸溶液的物质的量浓度为___________ 。
②关于该实验下列说法正确的是______________ (填写序号)。
a.取亚磷酸溶液的滴定管,洗涤后未润洗,导致结果偏低
b.盛高锰酸钾溶液的滴定管滴定前有气泡,滴定后无气泡,导致结果偏高
c.滴定过程中眼睛只注视滴定管中液面变化,并做好记录
d.锥形瓶未干燥底部有水,会导致结果偏低
(1)次磷酸(H3PO2)是一元酸,其电离常数的值K=9×103。向10 mL0.1 mol•L-1H3PO2溶液中加入30 mL等物质的量浓度的NaOH溶液,写出反应的离子方程式
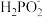 )+c(H3PO2)=
)+c(H3PO2)=(2)亚磷酸(H3PO3)是二元弱酸, 25℃时亚磷酸的电离常数的值为K1=1×10-2、
K2=2.6×10-7,则NaH2PO3溶液显性
(3)已知HF的电离常数的值为K=3.6×10-4,将足量HF溶液和Na2HPO3溶液反应,其离子方程式为
(4)亚磷酸具有强还原性。化学实验小组利用滴定法测定某亚磷酸溶液浓度,某25.00 mL的亚磷酸溶液放入锥形瓶中,用0.10 mol•L-1的高锰酸钾溶液进行滴定,反应的离子方程式是5H3PO3+2
 +6H+=5H3PO4+2Mn2++3H2O。三次滴定实验的数据分别如下:
+6H+=5H3PO4+2Mn2++3H2O。三次滴定实验的数据分别如下:| 实验编号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.50 | 22.50 |
| 2 | 1.50 | 23.60 |
| 3 | 1.00 | 22.90 |
②关于该实验下列说法正确的是
a.取亚磷酸溶液的滴定管,洗涤后未润洗,导致结果偏低
b.盛高锰酸钾溶液的滴定管滴定前有气泡,滴定后无气泡,导致结果偏高
c.滴定过程中眼睛只注视滴定管中液面变化,并做好记录
d.锥形瓶未干燥底部有水,会导致结果偏低
您最近一年使用:0次
名校
解题方法
7 . 下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Na2HPO4溶液中滴入酚酞 | 溶液变红色 | HPO 水解程度大于电离程度 水解程度大于电离程度 |
| B | 向浓度均为0.1000 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2] > Ksp[Cu(OH)2] |
| C | 向Na2CO3溶液中加入醋酸,将反应后的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:醋酸 > 碳酸 > 硅酸 |
| D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I ⇌I2+ I-平衡 ⇌I2+ I-平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 已知在 25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数如下:
HClO Ka=4.7×10-8 mol/L
H2CO3 Ka1=4.2×10-7 mol/L Ka2=5.6×10-11 mol/L
H2SO3 Ka1=1.54×10-2 mol/L Ka2=1.02×10-7 mol/L
(1)下列离子在溶液中不能大量共存的是_______
A. 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
(2)将少量 CO2 通入到 NaClO 溶液中发生反应的离子方程式_______
(3)常温常压下,空气中的 CO2 溶于水达到平衡时,溶液的 pH=5.60,c( H2CO3)=1.5×10-5mol·L-1.若忽略水的电离及 H2CO3 的第二级电离,已知 10-5.60=2.5×10-6,则 H2CO3⇌H++ 的平衡常数是
的平衡常数是_______
(4)实验室用 Zn 和稀硫酸制取 H2,反应时溶液中水的电离程度_______ (填“增大”“减小”或者“不变”);若加入少量下列固体试剂,可使产生 H2 的总量不变而速率减小的是_______ 。
a.NaNO3 b.CuSO4 c.CH3COONa d.Na2SO4
HClO Ka=4.7×10-8 mol/L
H2CO3 Ka1=4.2×10-7 mol/L Ka2=5.6×10-11 mol/L
H2SO3 Ka1=1.54×10-2 mol/L Ka2=1.02×10-7 mol/L
(1)下列离子在溶液中不能大量共存的是
A.
 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
(2)将少量 CO2 通入到 NaClO 溶液中发生反应的离子方程式
(3)常温常压下,空气中的 CO2 溶于水达到平衡时,溶液的 pH=5.60,c( H2CO3)=1.5×10-5mol·L-1.若忽略水的电离及 H2CO3 的第二级电离,已知 10-5.60=2.5×10-6,则 H2CO3⇌H++
 的平衡常数是
的平衡常数是(4)实验室用 Zn 和稀硫酸制取 H2,反应时溶液中水的电离程度
a.NaNO3 b.CuSO4 c.CH3COONa d.Na2SO4
您最近一年使用:0次
2020-12-21更新
|
231次组卷
|
3卷引用:甘肃省武威第一中学2020-2021学年高二上学期期中考试化学试题
甘肃省武威第一中学2020-2021学年高二上学期期中考试化学试题(已下线)练习8 弱电解质的电离-2020-2021学年【补习教材·寒假作业】高二化学(人教版)新疆哈密市第十五中学2020-2021学年高二上学期期末考试化学试题
名校
9 . 下列有关水溶液中的平衡相关的问题,请填空。
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式___ 。
(2)NaClO溶液显碱性的原因是___ (用离子方程式说明);常温时pH=10的NaClO溶液中c(Na+)-c(ClO-)=___ (填准确数值)mol·L-1。
(3)25℃时,三种弱酸的电离平衡常数如表所示:
①少量CO2通入NaClO溶液中反应的离子方程式___ ;
②在某CH3COOH和CH3COONa的混合液中,当 =
= 时,溶液的pH=
时,溶液的pH=___ 。
③下列离子①CO ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为___ 。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中 为
为___
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式
(2)NaClO溶液显碱性的原因是
(3)25℃时,三种弱酸的电离平衡常数如表所示:
| 分子式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①少量CO2通入NaClO溶液中反应的离子方程式
②在某CH3COOH和CH3COONa的混合液中,当
 =
= 时,溶液的pH=
时,溶液的pH=③下列离子①CO
 ②HCO
②HCO ③ClO-④CH3COO-结合质子能力由强到弱的顺序为
③ClO-④CH3COO-结合质子能力由强到弱的顺序为(4)已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。取一定量含有I-、Cl-的溶液向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中
 为
为
您最近一年使用:0次
解题方法
10 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
| B | 室温下,向NaCl和KI混合溶液中滴加AgNO3溶液,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的弱 |
| D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5 | HSO 结合H+的能力比SO 结合H+的能力比SO 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



