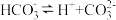解题方法
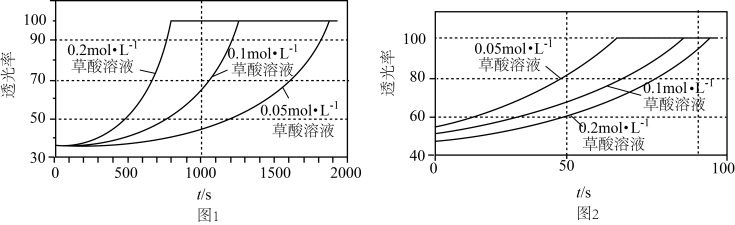
1 . 某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL0.001mol·L-1KMnO4溶液中分别加入不同浓度的草酸溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001mol·L-1KMnO4溶液,实验结果如图2。回答有关问题:
已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同) Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III)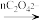 Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
(1)实验时发生总反应的离子方程式为___ 。
(2)由题可知,Mn(II)的作用是___ ;由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间___ (填“变大”、“变小”或“不变”)。
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
①请完成此实验设计:V5=___ ,V6=___ 。
②设计A号试管实验的目的是___ 。
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:___ 。
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是___ 。

已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同)
 Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III)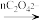 Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2(1)实验时发生总反应的离子方程式为
(2)由题可知,Mn(II)的作用是
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
| 试管编号 | 0.01mol•L-1KMnO4溶液/mL | 0.2mol•L-1 H2C2O4溶液/mL | 蒸馏水/mL | 2.0mol•L-1H2SO4溶液/mL |
| A | 4.0 | 2.0 | 2.0 | 0 |
| B | V1 | V2 | 1.5 | V3 |
| C | V4 | 2.0 | V5 | 1.0 |
| D | V6 | 2.0 | 0 | 2.0 |
①请完成此实验设计:V5=
②设计A号试管实验的目的是
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是
您最近一年使用:0次
2 . 下列方法不能证明CH3COOH的酸性比H2S强的是( )
| A.向Na2S溶液中滴加醋酸溶液 |
| B.测定0.1 mol/L CH3COOH溶液和0.l mol/L H2S溶液的pH |
| C.测定物质的量浓度相同的CH3COONa溶液和Na2S溶液的pH |
| D.常温下,pH=4的醋酸溶液和氢硫酸分别稀释100倍,测定稀释后溶液的pH |
您最近一年使用:0次
2020-11-21更新
|
224次组卷
|
2卷引用:黑龙江哈尔滨市第九中学2021届高三上学期第三次月考化学试题
3 . NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
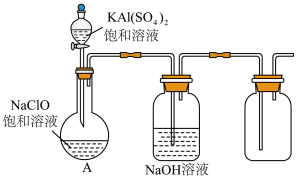
(1)NaClO溶液pH>7,用离子方程式表示原因________ 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是_____ 。
(3)某小组同学用如图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_____ 。
(4)已知在常温下测得浓度均为0.1 mol·L-1的下列5种溶液的pH:
判断下列反应不能成立的是_____ (填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO B.CO2+H2O+NaClO=NaHCO3+HClO
C.CH3COOH+NaCN=CH3COONa+HCN D.CH3COOH+NaClO=CH3COONa+HClO
(5)亚磷酸是中强酸,它与足量的NaOH溶液反应生成Na2HPO3。试回答下列问题:
①Na2HPO3中P元素的化合价为______ 。
②Na2HPO3是_____ (填“正盐”或者“酸式盐”),其溶液的pH___ 7(填“>”、“=”或“<”)。

(1)NaClO溶液pH>7,用离子方程式表示原因
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是
(3)某小组同学用如图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是
(4)已知在常温下测得浓度均为0.1 mol·L-1的下列5种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.CO2+H2O+2NaClO=Na2CO3+2HClO B.CO2+H2O+NaClO=NaHCO3+HClO
C.CH3COOH+NaCN=CH3COONa+HCN D.CH3COOH+NaClO=CH3COONa+HClO
(5)亚磷酸是中强酸,它与足量的NaOH溶液反应生成Na2HPO3。试回答下列问题:
①Na2HPO3中P元素的化合价为
②Na2HPO3是
您最近一年使用:0次
4 . 下表是几种常见弱酸的电离平衡常数(25 ℃):
回答下列问题:
(1)当温度升高时,K值________ (填“增大”“减小”或“不变”)。
(2)若把CH3COOH、H2CO3、 、H2S、HS-、H3PO4、H2PO
、H2S、HS-、H3PO4、H2PO 、HPO
、HPO 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是________ ,最弱的是________ 。
(3)若已知HClO的电离常数K=3.0×10-8,写出少量CO2通入过量的NaClO溶液中离子方程式:________________ 。
(4) 25℃时,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,二者恰好完全反应,则醋酸的电离平衡常数约为_______________ (用含a、b的式子表示)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3
| K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4
| K1=7.1×10-3 K2=6.3×10-8 K3=4.20×10-13 |
回答下列问题:
(1)当温度升高时,K值
(2)若把CH3COOH、H2CO3、
 、H2S、HS-、H3PO4、H2PO
、H2S、HS-、H3PO4、H2PO 、HPO
、HPO 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是(3)若已知HClO的电离常数K=3.0×10-8,写出少量CO2通入过量的NaClO溶液中离子方程式:
(4) 25℃时,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,二者恰好完全反应,则醋酸的电离平衡常数约为
您最近一年使用:0次
2020-11-18更新
|
162次组卷
|
2卷引用:湖南省临澧县第一中学2020-2021学年高二上学期期中考试化学试题(选考)
5 . (1)将足量的NaOH溶液滴入某酸(H3A)溶液中,发生反应:NaOH+H3A=NaH2A+H2O。则酸H3A是_______ (填入“一元酸、二元酸、三元酸、不能确定”中一个)。
(2)用电离方程式解释Na2HPO4溶液中有PO 的原因
的原因_____________
(3)表中是25℃时某些弱酸的电离常数,其中多元弱酸分步电离。
根据表中数据判断下述反应可以发生的是______ (填编号)
①NaF+CH3COOH=CH3COONa+HF
②HF+NaHCO3=NaF+H2O+CO2↑
③CH3COOH+K2C2O4=CH3COOK+KHC2O4
(4)少量CO2通入NaClO溶液中发生反应的离子方程式为___________ 。
(5)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加40ml0.1mol/L盐酸溶液,溶液中含碳元素的三种微粒H2CO3、HCO 、CO
、CO (CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
①各字母代表的粒子为b________ ,c________ 。
②在同一溶液中,H2CO3、HCO 、CO
、CO (填:“能”或“不能”)
(填:“能”或“不能”)______ 大量共存。
(2)用电离方程式解释Na2HPO4溶液中有PO
 的原因
的原因(3)表中是25℃时某些弱酸的电离常数,其中多元弱酸分步电离。
| 弱酸 | K | 弱酸 | K |
| HF | 3.53 10-4 10-4 | H2CO3 | K1=4.4 10-7 10-7K2=4.7  10-11 10-11 |
| HClO | 2.95 10-8 10-8 | ||
| HCOOH | 1.765 10-4 10-4 | H2C2O4 | K1=5.4 10-2 10-2K2=5.4  10-5 10-5 |
| CH3COOH | 1.753 10-5 10-5 |
①NaF+CH3COOH=CH3COONa+HF
②HF+NaHCO3=NaF+H2O+CO2↑
③CH3COOH+K2C2O4=CH3COOK+KHC2O4
(4)少量CO2通入NaClO溶液中发生反应的离子方程式为
(5)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加40ml0.1mol/L盐酸溶液,溶液中含碳元素的三种微粒H2CO3、HCO
 、CO
、CO (CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①各字母代表的粒子为b
②在同一溶液中,H2CO3、HCO
 、CO
、CO (填:“能”或“不能”)
(填:“能”或“不能”)
您最近一年使用:0次
名校
6 . 弱电解质在水溶液中的电离过程是一个可逆过程。常温下,关于弱电解质的电离过程,说法正确的是
A.0.1mol∙L-1醋酸溶液加水稀释,溶液中 减小 减小 |
| B.水是极弱的电解质,将金属Na加入水中,水的电离程度减小 |
| C.pH=3的醋酸溶液加水稀释10倍后3<pH<4 |
| D.若电离平衡向正向移动,则弱电解质的电离度一定增大 |
您最近一年使用:0次
2020-11-16更新
|
542次组卷
|
7卷引用:河北省唐山一中2020-2021学年高二上学期期中考试化学(选择考)试题
名校
7 . 25℃时,部分物质的电离平衡常数如下表所示:
请回答下列问题。
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________________ 。
(2)同浓度的CH3COO-、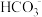 、
、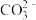 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为_________________________________________________
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:_____________ 。
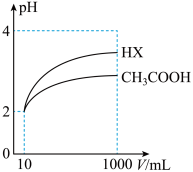
(4)10mLpH=2的醋酸与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数________ (填“大于”“等于”或“小于”)醋酸的电离平衡常数,理由是_________________________________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 |  =4.3×10-7 =4.3×10-7 =5.6×10-11 =5.6×10-11 | 4.7×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)同浓度的CH3COO-、
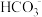 、
、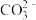 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:
(4)10mLpH=2的醋酸与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数

您最近一年使用:0次
2020-11-06更新
|
392次组卷
|
2卷引用:辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题
20-21高二上·全国·假期作业
名校
8 . 已知人体体液中存在如下平衡:CO2+H2O H2CO3
H2CO3 H++
H++ ,以维持体液pH的相对稳定。下列说法
,以维持体液pH的相对稳定。下列说法不合理 的是
 H2CO3
H2CO3 H++
H++ ,以维持体液pH的相对稳定。下列说法
,以维持体液pH的相对稳定。下列说法| A.当强酸性物质进入体液后,上述平衡向左移动,以维持体液pH的相对稳定 |
| B.当强碱性物质进入体液后,上述平衡向右移动,以维持体液pH的相对稳定 |
| C.若静脉滴注大量生理盐水,则体液的pH减小 |
| D.进行呼吸活动时,如果CO2进入血液,会使体液的pH减小 |
您最近一年使用:0次
2020-11-02更新
|
764次组卷
|
10卷引用:练习9 弱电解质的电离平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)
(已下线)练习9 弱电解质的电离平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)重庆市第七中学校2021-2022学年高二上学期期中考试化学试题四川省广安友谊中学2021-2022学年高二上学期11月质量检测化学试题(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.2.1 弱电解质的电离平衡-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第46练 弱电解质的电离平衡第1讲 弱电解质的电离平衡
名校
9 . 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) + OH﹣(aq) ═ H2O (l)△H=﹣57.3kJ•mol﹣1。分别向 1L 0.5mol•L﹣1 的 NaOH 溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应放出的热量分别为 Q1、Q2、Q3,下列关系正确的是
| A.Q1>Q3>Q2 | B.Q1<Q2<Q3 |
| C.Q1>Q2=Q3 | D.Q1=Q2<Q3 |
您最近一年使用:0次
2020-10-29更新
|
297次组卷
|
2卷引用:山西省太原市第五中学2020-2021学年高二上学期10月月考试题
名校
10 . 下表是25℃时某些弱酸的电离常数,期中多元弱酸分步电离。
(1)等浓度的表中三种有机羧酸溶液中,水电离出的氢离子浓度_____ >_____ .>______ .
(2)根据表中数据判断下述反应可以发生的是______ (填编号)
①NaF+CH3COOH===CH3COONa+HF
②CO2+2NaClO+H2O===2HClO+Na2CO3
③HF+NaHCO3===NaF+H2O+CO2↑
④CH3COOH+KHC2O4===CH3COOK+H2C2O4
(3)少量CO2通入NaCN溶液中发生反应的离子方程式为___________ 。
(4)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加0.1mol/L盐酸溶液,40ml,溶液中含碳元素的三种微粒H2CO3、 、
、 (CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
①各字母代表的粒子为b________ ,c__________ 。
②在同一溶液中,H2CO3、 、
、 (填:“能”或“不能”)
(填:“能”或“不能”)______ 大量共存。
③当pH=11时,溶液中含碳元素的主要微粒为________ 。
| 弱酸 | K |
| HF | 3.53×10-4 |
| HCN | 6.2×10-10 |
| HCOOH | 1.765×10-4 |
| CH3COOH | 1.753×10-5 |
| 弱酸 | K |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| H2C2O4 | K1=5.4×10-2 K2=4.7×10-5 |
(1)等浓度的表中三种有机羧酸溶液中,水电离出的氢离子浓度
(2)根据表中数据判断下述反应可以发生的是
①NaF+CH3COOH===CH3COONa+HF
②CO2+2NaClO+H2O===2HClO+Na2CO3
③HF+NaHCO3===NaF+H2O+CO2↑
④CH3COOH+KHC2O4===CH3COOK+H2C2O4
(3)少量CO2通入NaCN溶液中发生反应的离子方程式为
(4)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加0.1mol/L盐酸溶液,40ml,溶液中含碳元素的三种微粒H2CO3、
 、
、 (CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①各字母代表的粒子为b
②在同一溶液中,H2CO3、
 、
、 (填:“能”或“不能”)
(填:“能”或“不能”)③当pH=11时,溶液中含碳元素的主要微粒为
您最近一年使用:0次

 CH3COO-+H+
CH3COO-+H+