名校
解题方法
1 . Na2CO3和NaHCO3可作食用碱。下列方程式中正确的是( )
| A.Na2O2与CO2反应生成Na2CO3:Na2O2 +CO2=Na2CO3+O2 |
B.Na2CO3溶液呈碱性:CO32-+H2O H2CO3+2OH- H2CO3+2OH- |
C.NaHCO3可作发酵粉:2NaHCO3 Na2CO3+CO2↑ +H2O Na2CO3+CO2↑ +H2O |
| D.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+=CO2↑+H2O |
您最近一年使用:0次
2020-01-14更新
|
171次组卷
|
2卷引用:北京市房山区2020届高三上学期期末考试化学试题
解题方法
2 . 请依据化学知识回答下列问题:
(1)实验测得0.16g CH4完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。则CH4的燃烧热为________ kJmol-1。
(2)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s) MnO(s)+CO2(g) H1=+a kJmol-1
MnO(s)+CO2(g) H1=+a kJmol-1
ii.2MnO (s)+ O2(g) 2MnO2(s) H2=+b kJmol-1
2MnO2(s) H2=+b kJmol-1
请写出焙烧MnCO3制取MnO2的热化学方程式:______________________________________ 。
(3)下面是某同学探究可逆反应2NO2(g) N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
甲烧杯中NO2球的红棕色变浅。说明平衡2NO2(g) N2O4(g)向
N2O4(g)向________ (填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________ (填“放热”或“吸热”)过程。
(4)25°C时,部分物质的电离平衡常数如表所示:
请依此判断CH3COOH、H2CO3、HClO的酸性由强到弱的顺序是________________________
(1)实验测得0.16g CH4完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。则CH4的燃烧热为
(2)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)
 MnO(s)+CO2(g) H1=+a kJmol-1
MnO(s)+CO2(g) H1=+a kJmol-1ii.2MnO (s)+ O2(g)
 2MnO2(s) H2=+b kJmol-1
2MnO2(s) H2=+b kJmol-1请写出焙烧MnCO3制取MnO2的热化学方程式:
(3)下面是某同学探究可逆反应2NO2(g)
 N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。 | 1.向甲烧杯中加入NH4NO3晶体,此烧杯中NO2 球的红棕色变浅。 2.向乙烧杯中投入一定量的CaO固体,此烧杯中 NO2球的红棕色变深。 |
甲烧杯中NO2球的红棕色变浅。说明平衡2NO2(g)
 N2O4(g)向
N2O4(g)向(4)25°C时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请依此判断CH3COOH、H2CO3、HClO的酸性由强到弱的顺序是
您最近一年使用:0次
名校
解题方法
3 . (I)下表是25℃时某些弱酸的电离平衡常数。
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__ 。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK_____ NaClO,两溶液中:[c(Na+)-c(ClO-)]_____ [c(K+)-c(CH3COO-)]。
(3)碳酸钠溶液中滴加少量氯水的离子方程式为__________ 。
(II)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

(4)写出阳极的电极反应式_________ 。
(5)分析产品室可得到H3PO2的原因___________ 。
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK
(3)碳酸钠溶液中滴加少量氯水的离子方程式为
(II)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

(4)写出阳极的电极反应式
(5)分析产品室可得到H3PO2的原因
您最近一年使用:0次
名校
4 . 常温下,有下列五种溶液:
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH______ ③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______ ④
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是_______
A 中和时所需NaOH的量 B 电离程度
C 水电离出的c(H+) D CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是______ (填字母)。
A、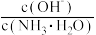 B、
B、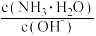
C、c(H+)和c(OH-)的乘积 D、 OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:________ 。
| ① | ② | ③ | ④ | ⑤ |
| 0.1 mol·L-1 CH3COOH溶液 | 0.01mol·L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 | 0.1 mol·L-1 NaOH溶液 | 0.1mol·L-1 氨水 |
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是
A 中和时所需NaOH的量 B 电离程度
C 水电离出的c(H+) D CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是
A、
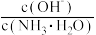 B、
B、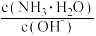
C、c(H+)和c(OH-)的乘积 D、 OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:
您最近一年使用:0次
5 . 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
 NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )| A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数 |
| B.液氨中含有NH3、NH4+、NH2-等粒子 |
| C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-) |
| D.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-) |
您最近一年使用:0次
名校
6 . 能使Al(OH)3的电离平衡向碱式电离方向移动的是( )
| A.HNO3 | B.H2CO3 | C.NaOH | D.氨水 |
您最近一年使用:0次
2019-04-04更新
|
290次组卷
|
2卷引用:【区级联考】上海市杨浦区2019届高三下学期二模化学试题
7 . 完成并分析下列化学原理
(1)在配制三氯化铁溶液时,为了防止发生水解,可以加入少量的________ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________ ;
(3)除去CuCl2溶液中少量的FeCl3,加入的试剂可以是_____________ 。
(4)在常温下,稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH随加水量的变化如图所示,能表示HF的稀释过程的曲线是:_____________

(5)amol·L-1(NH4)2SO4溶液pH=5,其原因是_______ (用相应的方程式说明)。
(6)有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。溶液中c(H+)由小到大 的顺序为:(填混合溶液的编号)____________
(7)在做Zn与稀H2SO4反应制取H2的实验中,向溶液中滴加几滴CuSO4溶液,反应放出H2速度加快的原因是:__________________________
(1)在配制三氯化铁溶液时,为了防止发生水解,可以加入少量的
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)除去CuCl2溶液中少量的FeCl3,加入的试剂可以是
(4)在常温下,稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH随加水量的变化如图所示,能表示HF的稀释过程的曲线是:

(5)amol·L-1(NH4)2SO4溶液pH=5,其原因是
(6)有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。溶液中c(H+)
(7)在做Zn与稀H2SO4反应制取H2的实验中,向溶液中滴加几滴CuSO4溶液,反应放出H2速度加快的原因是:
您最近一年使用:0次
真题
名校
8 . 中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
D.根据较强酸可以制取较弱酸的规律,推出 通入NaClO溶液中能生成HClO 通入NaClO溶液中能生成HClO |
您最近一年使用:0次
2019-01-30更新
|
1732次组卷
|
20卷引用:2011年普通高等学校招生全国统一考试化学卷(安徽)
2011年普通高等学校招生全国统一考试化学卷(安徽)(已下线)2011年福建省东山二中高二期末综合测试化学试题(已下线)2011-2012学年福建师大附中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省福州八中高二下学期期末考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二期末考试化学试卷2014-2015福建省四地六校高二下学期第一次联考化学试卷2015-2016学年湖北沙市中学高二下第一次半月考化学试卷2015-2016学年山西省康杰中学高二下期末化学试卷浙江省温州中学2016-2017学年高一下学期期中考试化学试题贵州省织金县第一中学2018-2019学年高二上学期期中考试化学试题贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——与pH相关的计算综合(基础过关)2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择基础专练】四川省遂宁市射洪县射洪中学校2019-2020学年高二下学期期中考试化学试题福建省莆田第二十五中学2020-2021学年高二下学期第一次月考化学试题甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题(已下线)1.2.2 元素周期律-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)天津市南开中学2021-2022学年高三上学期第二次月考化学试题
名校
9 . 下列实验中,对应的现象及结论都正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液一定为钠盐溶液 |
| B | 用浓盐酸和石灰石反应产生的气体直接通入Na2SiO3溶液中 | Na2SiO3溶液变浑浊 | C元素的非金属性大于Si元素 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 向某溶液中加入稀硝酸酸化的BaCl2 溶液 | 产生白色沉淀 | 该溶液中一定存在SO42- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-09更新
|
278次组卷
|
2卷引用:辽宁省普兰店市第一中学2019届高三上学期期中考试化学试题
10 . 浓度和体积都相等的盐酸(甲)和醋酸(乙),分别与形状相同且足量的锌反应,下列说法正确的是
| A.反应所需时间:甲=乙 |
| B.反应开始时的速率:甲=乙 |
| C.反应结束所消耗的锌的质量:甲=乙 |
| D.反应结束时的pH值:甲=乙 |
您最近一年使用:0次
2018-01-17更新
|
194次组卷
|
2卷引用:黑龙江省齐齐哈尔市2017-2018学年高二上学期期末考试化学试题



