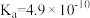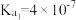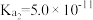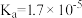1 . 已知部分弱酸的电离平衡常数如下表所示:
下列实验的反应原理用离子方程式表示不正确的是
| 弱酸 | 次氯酸 | 碳酸 | 亚硫酸 | 苯酚 |
| 电离平衡常数Ka(25℃) | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 | 1.28×10-10 |
下列实验的反应原理用离子方程式表示不正确的是
A.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 == == +2 +2 |
B.用碳酸氢钠溶液检验水杨酸中的羧基: + + → →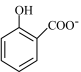 +H2O+CO2↑ +H2O+CO2↑ |
| C.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO |
D.少量的SO2通入苯酚钠溶液中:SO2+H2O+2  →2 →2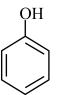 + SO32- + SO32- |
您最近一年使用:0次
名校
2 . 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种,请根据所学化学知识回答下列问题:
(1)①在25℃条件下将pH=12的氨水稀释过程中,下列关系式正确的_________ 。
A.能使溶液中c(NH4+):c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中 比值增大
比值增大
D.此过程中Kw增
②25℃时,向0.1 mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是_________ 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(2)①室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失),_____ 和______ 两种粒子的物质的量之和比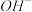 多0.1 mol。
多0.1 mol。
②已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系,若关系中C是正确的,则该溶质的化学式是__________ 。
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(Cl-)=c(NH4+)>c(H+)=c(OH-)
C. c(Cl-)>c(H+)>c(NH4+)>c(OH-) D. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(3)如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数。回答下列问题:
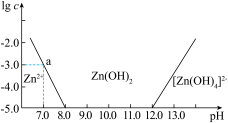
①向ZnCl2溶液中加入足量的氢氧化钠溶液,用离子方程式表示出反应的过程:_________________ 。
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________ 。
(1)①在25℃条件下将pH=12的氨水稀释过程中,下列关系式正确的
A.能使溶液中c(NH4+):c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中
 比值增大
比值增大D.此过程中Kw增
②25℃时,向0.1 mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(2)①室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失),
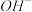 多0.1 mol。
多0.1 mol。②已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系,若关系中C是正确的,则该溶质的化学式是
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(Cl-)=c(NH4+)>c(H+)=c(OH-)
C. c(Cl-)>c(H+)>c(NH4+)>c(OH-) D. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(3)如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数。回答下列问题:

①向ZnCl2溶液中加入足量的氢氧化钠溶液,用离子方程式表示出反应的过程:
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=
您最近一年使用:0次
2020-09-12更新
|
266次组卷
|
3卷引用:安徽省合肥市第一中学2019-2020学年高二上学期段二(期中)考试化学试题
名校
3 . 硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀,实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:
下列结论正确的是
| 编号 | Ⅰ | Ⅱ |
| 实验 | 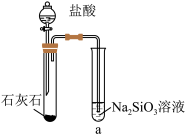 | 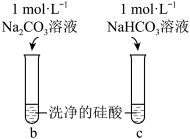 |
| 现象 | a中产生凝胶状沉淀 | b中凝胶状沉淀溶解,c中无明显变化 |
下列结论正确的是
| A.Na2SiO3溶液碱性比Na2CO3溶液强 |
| B.实验Ⅰ说明酸性H2CO3>H2SiO3 |
| C.实验Ⅱ说明同浓度时Na2CO3溶液的碱性强于NaHCO3溶液 |
D.向Na2SiO3溶液中通入过量CO2,发生反应: +CO2+H2O= +CO2+H2O= +H2SiO3↓ +H2SiO3↓ |
您最近一年使用:0次
2020-09-02更新
|
55次组卷
|
2卷引用:湖南省怀化市2019-2020学年高二下学期期末考试化学试题
4 . 常温下,有浓度均为0.1mol/L的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
(1)这4种溶液pH由大到小的排列顺序是_____________ (填序号);
(2)④的水解平衡常数Kh=___________ 。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_______ ④(填“>”“<”或“=”)。
(4)常温下NaCN溶液中,将粒子浓度由大到小排序________ (包括HCN)
向NaCN溶液中通入少量CO2,则发生反应的离子方程式为__________________ 。
(5) CO2可以被NaOH溶液捕获,若所得溶液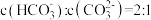 ,溶液pH=
,溶液pH=_________ 。
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
|
|
|
(1)这4种溶液pH由大到小的排列顺序是
(2)④的水解平衡常数Kh=
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(4)常温下NaCN溶液中,将粒子浓度由大到小排序
向NaCN溶液中通入少量CO2,则发生反应的离子方程式为
(5) CO2可以被NaOH溶液捕获,若所得溶液
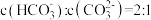 ,溶液pH=
,溶液pH=
您最近一年使用:0次
名校
解题方法
5 . 下列有关化学实验的叙述正确的是:
A. 与稀硝酸反应生成 与稀硝酸反应生成 ,推出 ,推出 也能与稀硝酸反应生成 也能与稀硝酸反应生成 |
B.配制 溶液时,通常向溶液中加入少量 溶液时,通常向溶液中加入少量 粉 粉 |
| C.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 |
| D.配制一定物质的量浓度的溶液,定容时仰视刻度线会使所配制的溶液浓度偏高 |
您最近一年使用:0次
名校
解题方法
6 . 常温下,下列有关溶液的说法正确的是( )
| A.pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液:NH4+浓度的大小顺序为①>②>③ |
| B.常温下,pH为5的氯化铵溶液和pH为5的醋酸溶液中水的电离程度相同 |
| C.HA的电离常数Ka=4.93×10-10,则等浓度的NaA、HA混合溶液中:c(Na+)>c(HA)>c(A-) |
| D.已知在相同条件下酸性HF>CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
您最近一年使用:0次
2020-04-21更新
|
204次组卷
|
3卷引用:山西省长治市2020届高三(3月在线)理综化学试题
7 . 磷是重要的元素,能形成多种含氧酸。回答下列问题:
(1)次磷酸(H3PO2)是一元酸,其电离常数的值K=9×103。向10mL0.1 mol•L-1H3PO2溶液中加入30mL等物质的量浓度的NaOH溶液,写出反应的离子方程式_________ ,c(Na+)+(H2PO2-)+c(H3PO2)=______ (忽略混合后溶液体积的变化)。
(2)亚磷酸(H3PO3)是二元弱酸, 25℃时亚磷酸的电离常数的值为K1=1×10-2、k2=2.6×10-7,则NaH2PO3溶液显性_____ (填“酸”“碱”或“中”),原因是____ (结合化学用语及数据计算进行解释)
(3)已知HF的电离常数的值为K=3.6×10-4,将足量HF溶液和Na2HPO3溶液反应,其离子方程式为______ 。
(4)亚磷酸具有强还原性。化学实验小组利用滴定法测定某亚磷酸溶液的浓度,取25.00mL的亚磷酸溶液放入锥形瓶中,用0.10 mol•L-1的高锰酸钾溶液进行滴定,反应的离子方程式是5H3PO3+ 2MnO4-+6H+ = 5H3PO4+ 2Mn2+ +3H2O。
三次滴定实验的数据分别如下:
①亚磷酸溶液的物质的量浓度为______ 。
②关于该实验下列说法正确的是______ (填写序号)。
a 取亚磷酸溶液的滴定管,洗涤后未润洗,导致结果偏低
b 盛高锰酸钾溶液的滴定管滴定前有气泡,滴定后无气泡,导致结果偏高
c 滴定过程中眼睛只注视滴定管中液面变化,并做好记录
d 锥形瓶未干燥底部有水,会导致结果偏低
(1)次磷酸(H3PO2)是一元酸,其电离常数的值K=9×103。向10mL0.1 mol•L-1H3PO2溶液中加入30mL等物质的量浓度的NaOH溶液,写出反应的离子方程式
(2)亚磷酸(H3PO3)是二元弱酸, 25℃时亚磷酸的电离常数的值为K1=1×10-2、k2=2.6×10-7,则NaH2PO3溶液显性
(3)已知HF的电离常数的值为K=3.6×10-4,将足量HF溶液和Na2HPO3溶液反应,其离子方程式为
(4)亚磷酸具有强还原性。化学实验小组利用滴定法测定某亚磷酸溶液的浓度,取25.00mL的亚磷酸溶液放入锥形瓶中,用0.10 mol•L-1的高锰酸钾溶液进行滴定,反应的离子方程式是5H3PO3+ 2MnO4-+6H+ = 5H3PO4+ 2Mn2+ +3H2O。
三次滴定实验的数据分别如下:
| 实验编号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.50 | 22.50 |
| 2 | 1.50 | 24.50 |
| 3 | 1.00 | 22.00 |
②关于该实验下列说法正确的是
a 取亚磷酸溶液的滴定管,洗涤后未润洗,导致结果偏低
b 盛高锰酸钾溶液的滴定管滴定前有气泡,滴定后无气泡,导致结果偏高
c 滴定过程中眼睛只注视滴定管中液面变化,并做好记录
d 锥形瓶未干燥底部有水,会导致结果偏低
您最近一年使用:0次
解题方法
8 . 硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式______
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:____ Mn2++____ S2O82﹣+____ H2O→____ MnO4﹣+____ SO42﹣+______ H+。配平该反应方程式,氧化产物是______
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在______ (填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到______ g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣ H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____ ,第4位的离子是____ 。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中
____ (填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣⇌H++SO32﹣K=1.02×10﹣7,NH4++H2O⇌NH3•H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是____ (选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3•H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3•H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3•H2O+SO32﹣
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在
(4)已知硫酸的第二级电离并不完全:HSO4﹣
 H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是
(5)已知:HSO3﹣⇌H++SO32﹣K=1.02×10﹣7,NH4++H2O⇌NH3•H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3•H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3•H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3•H2O+SO32﹣
您最近一年使用:0次
名校
9 . 强酸制弱酸非常重要的一种离子反应,已知:
下列离子反应不正确的有( )个
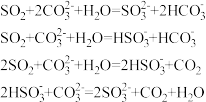
| Ka1 | Ka2 | |
| H2SO3 | 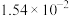 | 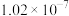 |
| H2CO3 | 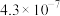 | 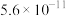 |
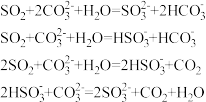
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
名校
10 . 已知常温下三种酸的电离平衡常数如表所示:
下列说法不正确的是( )
| HCN | H2CO3 | HF |
| 4.9×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 | 6.7×10-4 |
下列说法不正确的是( )
| A.相同物质的量浓度的HCN和HF溶液中,HF溶液中水的电离程度最小 |
| B.相同物质的量浓度的NaCN、Na2CO3和NaF溶液,Na2CO3溶液pH最大 |
| C.相同物质的量浓度的NaCN和NaF溶液中,[F-]+[OH-]>[CN-]+[OH-] |
| D.在NaCN溶液中通入少量CO2,离子方程式为:2CN-+H2O+CO2=2HCN+CO32- |
您最近一年使用:0次
2020-01-23更新
|
96次组卷
|
4卷引用:2020届高三化学二轮冲刺新题专练——弱电解质的电离应用
2020届高三化学二轮冲刺新题专练——弱电解质的电离应用(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)山西省长治市第二中学校2020-2021学年高二上学期第二次月考化学试题广东省揭阳华侨高级中学2021-2022学年高三上学期第三次阶段考试化学试题