名校
1 . 已知25℃时,部分弱电解质的电离平衡常数如表:
下列离子方程式或守恒关系正确的是
| 弱电解质 | HClO | H2CO3 | H2SO3 | NH3·H2O |
| 电离平衡常数 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.5×10-2 Ka2=6.0×10-8 | Kb=1.75×10-5 |
A.将Cl2通入到过量Na2CO3溶液中:Cl2+H2O+CO =HCO =HCO +HClO+Cl- +HClO+Cl- |
B.将SO2通入到NaClO溶液中:ClO-+H2O+SO2=HClO+HSO |
C.向亚硫酸溶液中加入氨水至中性:c(NH )=c(SO )=c(SO )+c(H2SO3)+c(HSO )+c(H2SO3)+c(HSO ) ) |
D.向过量Na2CO3溶液中通入少量SO2:SO2+H2O+2CO =2HCO =2HCO +SO +SO |
您最近一年使用:0次
2022-03-13更新
|
350次组卷
|
3卷引用:湖北省武汉市部分重点中学2021-2022学年高二上学期期末联考化学试题
2 . 常温下,两种酸的电离平衡常数如表:
常温下,浓度均为0.1mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是
| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A.pH:Na2CO3溶液小于Na2SO3溶液 |
B.①与②溶液等体积混合后的溶液中:c(SO )>c(CO )>c(CO )>c(HCO )>c(HCO )>c(HSO )>c(HSO ) ) |
C.结合H+能力:CO 弱于SO 弱于SO |
D.NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO |
您最近一年使用:0次
名校
3 . 下列实验设计能达到实验目的的是
| 选项 | 实验设计 | 实验目的 |
| A | 向NaAlO2溶液中加入NaHCO3溶液,观察到有白色沉淀生成 | 证明AlO 得质子的能力强于CO 得质子的能力强于CO |
| B | 将工业酒精加入蒸馏烧瓶进行蒸馏 | 工业酒精制备无水乙醇 |
| C | 用湿润的淀粉-KI试纸检验 | 鉴别红棕色的溴蒸气和NO2 |
| D | 向NaCl、NaI的混合溶液中滴加少量AgNO3溶液,生成淡黄色沉淀 | 证明Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)25℃时,等浓度的三种溶液,酸性最强的是___________ ,一般情况下,当温度升高时,Ka ___________ (填“增大”、“减小”或“不变”);
(2)室温下,某溶液中存在着CH3COOH(aq)+ (aq)
(aq) CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K=
CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K=___________ 。(用Ka、K1或K2表示)
(3)用蒸馏水稀释 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是___________ (填序号)
a.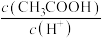 b.
b.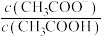 c.
c.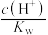 d.
d.
(4)泡沫灭火器(里面装饱和NaHCO3溶液和Al2(SO4)3溶液)的工作原理(用离子方程式表示)___________ 。
(5)证明ClO-结合质子的能力强于HCO (写出相应反应离子方程式并注明过量少量)
(写出相应反应离子方程式并注明过量少量)___________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)25℃时,等浓度的三种溶液,酸性最强的是
(2)室温下,某溶液中存在着CH3COOH(aq)+
 (aq)
(aq) CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K=
CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K=(3)用蒸馏水稀释
 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是a.
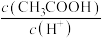 b.
b.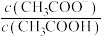 c.
c.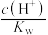 d.
d.
(4)泡沫灭火器(里面装饱和NaHCO3溶液和Al2(SO4)3溶液)的工作原理(用离子方程式表示)
(5)证明ClO-结合质子的能力强于HCO
 (写出相应反应离子方程式并注明过量少量)
(写出相应反应离子方程式并注明过量少量)
您最近一年使用:0次
名校
5 . 食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
请回答下列问题:
(1)HCO 、CO
、CO 、CN-结合质子(H+)的能力从小到大的顺序为
、CN-结合质子(H+)的能力从小到大的顺序为___________ 。
(2)CO2通入NaNO2溶液中能否生成HNO2___________ ,理由是___________ 。
(3)少量CO2通入足量NaCN溶液中,反应的离子方程式为___________ 。
(4)常温下,将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1 HNO2溶液分别与20 mL 0.10 mol·L-1 NaHCO3溶液混合(混合后溶液体积变化忽略不计)。反应开始时,v(CH3COOH)___________ v(HNO2)(填“>”“<”或“=”)。
(5)25 ℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =
=___________ 。
(6)常温下,下列方法可以使0.1 mol·L-1 CH3COOH的电离程度增大的是___________。
| 弱酸 | CH3COOH | H2CO3 | HNO2 | HCN |
| 电离常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=5.0×10-4 | Ka=6.2×10-10 |
(1)HCO
 、CO
、CO 、CN-结合质子(H+)的能力从小到大的顺序为
、CN-结合质子(H+)的能力从小到大的顺序为(2)CO2通入NaNO2溶液中能否生成HNO2
(3)少量CO2通入足量NaCN溶液中,反应的离子方程式为
(4)常温下,将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1 HNO2溶液分别与20 mL 0.10 mol·L-1 NaHCO3溶液混合(混合后溶液体积变化忽略不计)。反应开始时,v(CH3COOH)
(5)25 ℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
 =
=(6)常温下,下列方法可以使0.1 mol·L-1 CH3COOH的电离程度增大的是___________。
| A.加入少量的稀盐酸 | B.加热溶液 |
| C.加水稀释 | D.加入少量冰醋酸 |
您最近一年使用:0次
2021-12-29更新
|
192次组卷
|
2卷引用:安徽省马鞍山市第二中学2021-2022学年高二上学期期中考试化学试题
6 . 水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_____ mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___________ 。
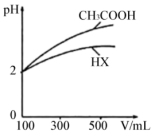
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___________ (填“大于”或“小于”或“等于”)CH3COOH的电离平衡常数,理由是___________ 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___________ 。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ mol·L-1(填精确值)。
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
2021-12-25更新
|
358次组卷
|
7卷引用:河南省洛阳市2019-2020学年高二上学期期末考试化学试题
河南省洛阳市2019-2020学年高二上学期期末考试化学试题(已下线)3.2.1 水的电离 溶液的酸碱性与pH 练习-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题江西省赣州市信丰中学2021-2022学年高二下学期A+班段考化学试题江西省吉安市2021-2022学年高二上学期期末教学质量检测化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题
7 . 疫情期间,某项目化学学习小组开展了对84消毒液使用安全性的研究。查找资料可知:
①84消毒液有效成分为NaClO。含氯消毒剂中HClO的消毒效果远高于ClO-,而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7,K2=5.6×10-11。
请回答下列问题:
(1)在84消毒液中滴加几滴酚酞试液,可观察到的现象是_______ 。
(2)通常购买的84消毒液pH在12左右,目的是增强消毒液的稳定性,试从平衡的角度分析原因_______ 。
(3)84消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,试写出该反应的离子方程式:_______ 。
(4)为了研究消毒效果,同学们测定了84消毒液中Cl2、HClO和ClO-三种微粒的物质的量分数随pH变化的关系,如图所示。
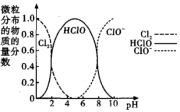
根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因_______ 。
(5)84消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中 完全转化为N2,请写出相应的离子反应方程式:
完全转化为N2,请写出相应的离子反应方程式:_______ 。若处理废水产生了0.448LN2(标准状况),则需消耗有效氯为5%的84消毒液的质量为_______ g。(“有效氯”指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,常以百分数表示)
①84消毒液有效成分为NaClO。含氯消毒剂中HClO的消毒效果远高于ClO-,而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7,K2=5.6×10-11。
请回答下列问题:
(1)在84消毒液中滴加几滴酚酞试液,可观察到的现象是
(2)通常购买的84消毒液pH在12左右,目的是增强消毒液的稳定性,试从平衡的角度分析原因
(3)84消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,试写出该反应的离子方程式:
(4)为了研究消毒效果,同学们测定了84消毒液中Cl2、HClO和ClO-三种微粒的物质的量分数随pH变化的关系,如图所示。

根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因
(5)84消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中
 完全转化为N2,请写出相应的离子反应方程式:
完全转化为N2,请写出相应的离子反应方程式:
您最近一年使用:0次
8 . 25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka___________ 填“增大”、“减小”或“不变”。
(2)下列四种离子结合质子能力由大到小的顺序是___________ 填序号;
a.CO b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是___________ 填序号
a.CO +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=2ClO-+CO2↑+H2O
+2HClO=2ClO-+CO2↑+H2O
d.2ClO-+CO2+H2O=CO +2HClO
+2HClO
(4)用蒸馏水稀释0.10mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___________ 填序号;
a. b.
b. c.
c.
| 化学式 |  |  | HClO |
| 电离平衡常数 | 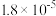 |  , ,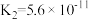 | 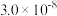 |
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO
 b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是
a.CO
 +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2Ob.ClO-+CH3COOH=CH3COO-+HClO
c.CO
 +2HClO=2ClO-+CO2↑+H2O
+2HClO=2ClO-+CO2↑+H2Od.2ClO-+CO2+H2O=CO
 +2HClO
+2HClO(4)用蒸馏水稀释0.10mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是
a.
 b.
b. c.
c.
您最近一年使用:0次
2021-11-19更新
|
480次组卷
|
2卷引用:浙江省S9联盟2021-2022学年高二上学期期中联考化学试题
名校
9 . 回答下列问题。
(1)在48mL0.1mol/L HNO3溶液中加入12mL0.4mol/LKOH溶液,所得溶液呈___________ (填酸性、碱性、中性)
(2)25℃时,a mol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=___________ (精确计算式)。
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++ HSeO ,HSeO
,HSeO
 H++SeO
H++SeO ,Ka=10×10-2 (25℃)。
,Ka=10×10-2 (25℃)。
①向H2SeO4溶液中滴加少量氢氧化钠稀溶液,该反应的离子方程式为___________ 。
②已知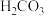 的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为
的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为___________ 。
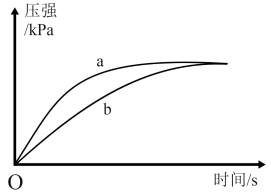
(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,。在该温度下向两个锥形瓶中各加入0.5g NaHCO3粉末,塞紧橡胶塞,然后用注射器分别注入2mL2mol/LCH3COOH溶液和2mL2mol/LHSCN溶液,测得锥形瓶内气体的压强随时间的变化如图所示,则曲线___________ 表示HSCN溶液(填a或b)。
(1)在48mL0.1mol/L HNO3溶液中加入12mL0.4mol/LKOH溶液,所得溶液呈
(2)25℃时,a mol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++ HSeO
 ,HSeO
,HSeO
 H++SeO
H++SeO ,Ka=10×10-2 (25℃)。
,Ka=10×10-2 (25℃)。①向H2SeO4溶液中滴加少量氢氧化钠稀溶液,该反应的离子方程式为
②已知
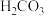 的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为
的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,。在该温度下向两个锥形瓶中各加入0.5g NaHCO3粉末,塞紧橡胶塞,然后用注射器分别注入2mL2mol/LCH3COOH溶液和2mL2mol/LHSCN溶液,测得锥形瓶内气体的压强随时间的变化如图所示,则曲线

您最近一年使用:0次
10 . 下列各项比较中,排列顺序正确的是
①固体的溶解性: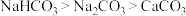
②碱金属密度: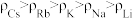
③微粒半径:
④结合质子的能力: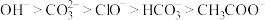
⑤沸点:
①固体的溶解性:
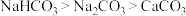
②碱金属密度:
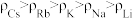
③微粒半径:

④结合质子的能力:
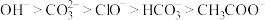
⑤沸点:

| A.①③ | B.②④ | C.③④ | D.③⑤ |
您最近一年使用:0次



