1 . 下列反应的离子方程式表示错误的是
A.泡沫灭火器的反应原理: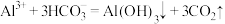 |
B.硝酸银溶液中加入足量稀氨水: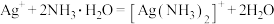 |
C.少量 通入 通入 溶液中: 溶液中: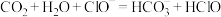 |
D.硫化氢通入 溶液中: 溶液中: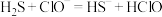 |
您最近一年使用:0次
2024-02-02更新
|
67次组卷
|
2卷引用:山东省济南市2023-2024学年高二上学期1月期末化学试题
2 . 食醋是烹饪美食的调味品,有效成分主要为乙酸,回答下列问题:
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫___________ ,乙酸的官能团是___________ (写名称).
(2)实验室常用图装置制备乙酸乙酯.
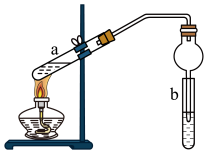
①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是___________ ,浓硫酸的作用是___________ ,a试管中主要反应的化学方程式为______________________________ .
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________ .
(3)醋酸能除水垢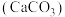 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________________ .
(4) ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
①
___________ ;②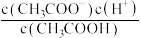
___________ ;③
___________ .
(5)室温下,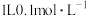 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为___________ .
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫
(2)实验室常用图装置制备乙酸乙酯.

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是
(3)醋酸能除水垢
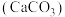 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)
 ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).①

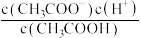

(5)室温下,
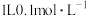 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为
您最近一年使用:0次
名校
3 . 化学中,酸的电离平衡常数( )是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
)是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
回答下列问题:
(1)T℃下, 的电离平衡常数为
的电离平衡常数为 ,则T
,则T___________ 25℃(选填“>”、“<”或“=”)估算T℃下, 溶液的
溶液的
___________ mol/L;保持温度不变,将该溶液加水稀释至0.01mol/L下列物理量增大的是___________ 。
a. b.
b.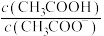 c.
c. d.电离度α
d.电离度α
(2)根据以上数据,写出将少量 气体通入NaClO溶液反应的离子方程式:
气体通入NaClO溶液反应的离子方程式:___________ 。
(3) 是一元酸,其在水中的电离方程式为:
是一元酸,其在水中的电离方程式为: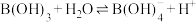 。利用上表中的数据,计算反应
。利用上表中的数据,计算反应 的平衡常数
的平衡常数___________ (列出原始计算式,不计算结果)
(4) 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,试写出
,试写出 酸式电离的电离方程式:
酸式电离的电离方程式:___________ 。根据上表中的数据,写出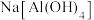 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
 )是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
)是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):| 酸 |  |  | HClO |  |  |
 |  | 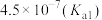 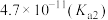 |  | 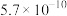 | 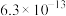 |
(1)T℃下,
 的电离平衡常数为
的电离平衡常数为 ,则T
,则T 溶液的
溶液的
a.
 b.
b.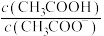 c.
c. d.电离度α
d.电离度α(2)根据以上数据,写出将少量
 气体通入NaClO溶液反应的离子方程式:
气体通入NaClO溶液反应的离子方程式:(3)
 是一元酸,其在水中的电离方程式为:
是一元酸,其在水中的电离方程式为: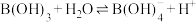 。利用上表中的数据,计算反应
。利用上表中的数据,计算反应 的平衡常数
的平衡常数(4)
 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,试写出
,试写出 酸式电离的电离方程式:
酸式电离的电离方程式: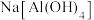 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:
您最近一年使用:0次
名校
4 . 按要求完成下列试题:
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,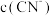
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:A. 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填编号)。
③室温下,一定浓度的 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=___________ 。
④将少量 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是___________ 。
(2)室温下, 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中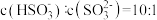 ,溶液的pH=
,溶液的pH=___________ 。(室温下, 的
的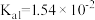 ;
; )
)
II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为_______ ;B的原子核外电子运动状态有_________ 种,
(4)C的最外层电子排布式为________ ;D的原子结构示意图为________ 。
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
| 弱酸 |  | HCN |  |
| 电离常数(25℃) |  | 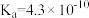 |  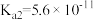 |
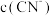
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②常温下,pH相同的三种溶液:A.
 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是③室温下,一定浓度的
 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=④将少量
 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是(2)室温下,
 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中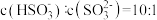 ,溶液的pH=
,溶液的pH= 的
的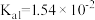 ;
; )
)II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为
(4)C的最外层电子排布式为
您最近一年使用:0次
名校
解题方法
5 . 已知:
(1)浓度均为0.1mol/L的下列四种溶液,pH由小到大排列的顺序是___________ (填标号)。
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是___________ (填标号)。
A.c(H+) B. C.
C. D.
D. E.
E.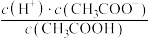
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸___________ 盐酸(填“>”、“<”或“=”)。
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =___________ 。
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈___________ (填标号)。
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为___________ (忽略溶液混合时体积的变化)。
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为___________ 。
| CH3COOH | H2CO3 | HClO | H2C2O4 | NH3·H2O | |
| 电离平衡常数 (25℃) |  |   | Ka= | Ka1=5.6×10-2 Ka2=5.4×10-5 |  |
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是
A.c(H+) B.
 C.
C. D.
D. E.
E.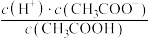
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为
您最近一年使用:0次
名校
6 . 下列反应的离子方程式正确的是
A.NaAlO2溶液与NaHCO3溶液混合: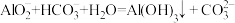 |
B.过量铁粉加入稀硝酸中: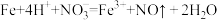 |
C.已知酸性:HClO>HCO3-,NaClO溶液中通入少量CO2: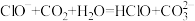 |
D.Mg(HCO3)2溶液中滴加过量Ca(OH)2: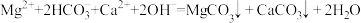 |
您最近一年使用:0次
7 . 回答下列问题
(1)下列物质中属于强电解质的是___________ (填序号)。
①稀硫酸 ②硫酸钡 ③熔融氯化钠 ④氯水 ⑤醋酸铵
(2)已知水的电离平衡曲线如图所示。
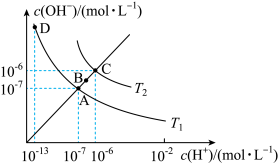
①写出使A点变为B点的措施:___________ ,采取该措施的原因是___________ 。
②向水中滴加适量NaOH溶液可实现A点→D点的变化,则D点对应溶液的pH为___________ 。
③ ℃时,
℃时, 的NaOH溶液中
的NaOH溶液中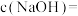
___________ ,若向该溶液中滴加 盐酸使溶液呈中性,则所用溶液的体积比
盐酸使溶液呈中性,则所用溶液的体积比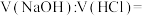
___________ 。
(3)常温下,碳酸的电离平衡常数为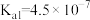 、
、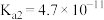 ;次氯酸的电离平衡常数
;次氯酸的电离平衡常数 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(1)下列物质中属于强电解质的是
①稀硫酸 ②硫酸钡 ③熔融氯化钠 ④氯水 ⑤醋酸铵
(2)已知水的电离平衡曲线如图所示。

①写出使A点变为B点的措施:
②向水中滴加适量NaOH溶液可实现A点→D点的变化,则D点对应溶液的pH为
③
 ℃时,
℃时, 的NaOH溶液中
的NaOH溶液中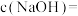
 盐酸使溶液呈中性,则所用溶液的体积比
盐酸使溶液呈中性,则所用溶液的体积比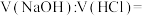
(3)常温下,碳酸的电离平衡常数为
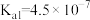 、
、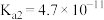 ;次氯酸的电离平衡常数
;次氯酸的电离平衡常数 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为
您最近一年使用:0次
名校
8 .  时,
时, 的电离常数
的电离常数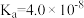 ,
, 的电离常数
的电离常数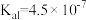 、
、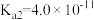 。下列说法
。下列说法不正确 的是
 时,
时, 的电离常数
的电离常数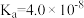 ,
, 的电离常数
的电离常数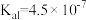 、
、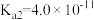 。下列说法
。下列说法A. 溶液和 溶液和 溶液中离子种类相同 溶液中离子种类相同 |
B. 时,反应 时,反应 的 的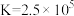 |
C. ,物质的量浓度相同的 ,物质的量浓度相同的 溶液与 溶液与 溶液的 溶液的 :前者小于后者 :前者小于后者 |
D.向氯水中加入少量 固体, 固体, 增大 增大 |
您最近一年使用:0次
2023-05-07更新
|
551次组卷
|
3卷引用:北京市东城区2022-2023学年高三第二次模拟考试化学试题
名校
9 .  与人类息息相关。近年来,为了缓解温室效应,
与人类息息相关。近年来,为了缓解温室效应, 的资源化利用是化学研究热点之一。科学家提出了多种回收和利用
的资源化利用是化学研究热点之一。科学家提出了多种回收和利用 的方案。
的方案。
(1)人体血液中存在平衡 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:_______ 。
(2)利用 制备
制备 可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol
可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol 和8mol
和8mol 发生反应:
发生反应:
 ,混合气体中
,混合气体中 的浓度与反应时间的关系如图所示,回答下列问题:
的浓度与反应时间的关系如图所示,回答下列问题:
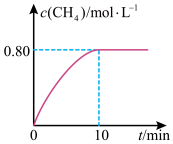
①下列说法正确的是_______ 。
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol 和8mol
和8mol ,重新达到平衡时
,重新达到平衡时 的浓度小于1.6mol/L
的浓度小于1.6mol/L
②从反应开始到10min, 的平均反应速率
的平均反应速率
_______ 。
③300℃时,反应的平衡常数K=_______ 。
④500℃该反应达到平衡时,上述容器中有1.6mol 、2.0mol
、2.0mol 、5.6mol
、5.6mol 、4.0mol
、4.0mol 。
。
则
_______ 0(填“>”“<”或“=”)
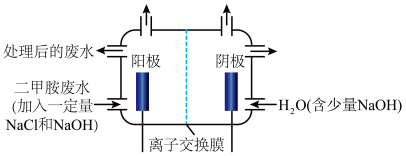
(3)化工废水中常常含有以二甲胺(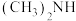 )为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
反应原理是:(i) 在阳极转化为
在阳极转化为 ;
;
(ii) 在碱性溶液中歧化为
在碱性溶液中歧化为 ;
;
(iii) 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和 。
。
①写出电解池中阴极发生反应的方程式_______ 。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是_______ 。
③当阴极区收集到6.72L(标况下) 时,阳极区收集到
时,阳极区收集到 的体积(标况下)是
的体积(标况下)是_______ L。
 与人类息息相关。近年来,为了缓解温室效应,
与人类息息相关。近年来,为了缓解温室效应, 的资源化利用是化学研究热点之一。科学家提出了多种回收和利用
的资源化利用是化学研究热点之一。科学家提出了多种回收和利用 的方案。
的方案。(1)人体血液中存在平衡
 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:(2)利用
 制备
制备 可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol
可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol 和8mol
和8mol 发生反应:
发生反应:
 ,混合气体中
,混合气体中 的浓度与反应时间的关系如图所示,回答下列问题:
的浓度与反应时间的关系如图所示,回答下列问题:
①下列说法正确的是
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol
 和8mol
和8mol ,重新达到平衡时
,重新达到平衡时 的浓度小于1.6mol/L
的浓度小于1.6mol/L②从反应开始到10min,
 的平均反应速率
的平均反应速率
③300℃时,反应的平衡常数K=
④500℃该反应达到平衡时,上述容器中有1.6mol
 、2.0mol
、2.0mol 、5.6mol
、5.6mol 、4.0mol
、4.0mol 。
。则

(3)化工废水中常常含有以二甲胺(
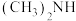 )为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
反应原理是:(i)
 在阳极转化为
在阳极转化为 ;
;(ii)
 在碱性溶液中歧化为
在碱性溶液中歧化为 ;
;(iii)
 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和 。
。①写出电解池中阴极发生反应的方程式
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是
③当阴极区收集到6.72L(标况下)
 时,阳极区收集到
时,阳极区收集到 的体积(标况下)是
的体积(标况下)是
您最近一年使用:0次
名校
10 . 砷(As)与氮(N)是同主族元素,它们的化合物在生活、生产和科学研究中有重要的作用。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为___________ (用离子方程式表示)。常温下,HNO2电离常数Ka(HNO2)约为___________ 。
(2)查阅资料知:5 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为___________ 。通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是___________ (填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是___________ (填化学式)。欲用1L NaNO2溶液将0.01mol AgCl完全转化为AgNO2,则NaNO2溶液的浓度需要满足___________ 。
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
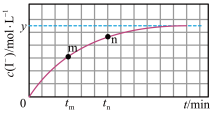
①m点时υ逆___________ n点时υ正(填“>”、“=”或“<”)。
②若平衡时溶液的pH=13,该反应的平衡常数K=___________ (用含y的代数式表示)。
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)___________ c( )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中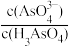 =
=___________ 。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为
(2)查阅资料知:5
 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
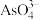 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
①m点时υ逆
②若平衡时溶液的pH=13,该反应的平衡常数K=
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)
 )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中
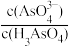 =
=
您最近一年使用:0次



