1 . 化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25°C时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。回答下列问题:
(1)改变下列条件,能使CH3COONa稀溶液中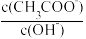 保持增大的是
保持增大的是__ 。
A.升温 B.加入NaOH固体 C.稀释 D.加入CH3COONa固体
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序__ 。
(3)人体血液里主要通过碳酸氢盐缓冲体系(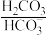 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,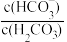 ≈
≈ ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为__ ,当过量的酸进入血液中时,血液缓冲体系中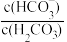 的值将
的值将__ (填“增大”“减小”或“不变”)。
(1)改变下列条件,能使CH3COONa稀溶液中
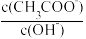 保持增大的是
保持增大的是A.升温 B.加入NaOH固体 C.稀释 D.加入CH3COONa固体
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序
(3)人体血液里主要通过碳酸氢盐缓冲体系(
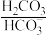 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,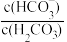 ≈
≈ ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为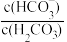 的值将
的值将
您最近一年使用:0次
2 . NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式
第一步水解的离子方程式______ 。已知25℃时,CO 第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO ):c(CO
):c(CO )=20:1 时,溶液的pH=
)=20:1 时,溶液的pH=______ 。
②泡沫灭火器中通常装有NaHCO溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式______ 。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmol•L﹣1CH3COONa溶液,则两份溶液中c(NO )、c(NO
)、c(NO )和c(CH3COO﹣)由大到小的顺序为
)和c(CH3COO﹣)由大到小的顺序为______ (已知HNO2的电离常数Ka=7.1×10﹣4mol•L﹣1,CH3COOH的电离常数Ka=1.7×10﹣5mol•L﹣1)。可使溶液A和溶液 B的 pH相等的方法是______ 。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收吸收SO2的过裎中,溶液中H2SO3、HSO 、SO
、SO 三者所占物质的量分数(a)随pH变化的关系如图所示:
三者所占物质的量分数(a)随pH变化的关系如图所示:
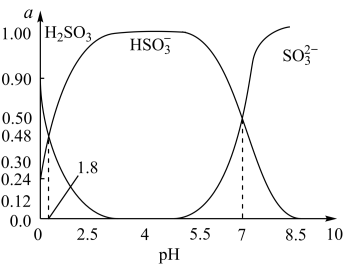
图中pH=7时,溶液中离子浓度关系正确的是______ 。
A.c(Na+)>2c(SO )>c(HSO
)>c(HSO )
)
B.c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO3)
)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO )
)
D.c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H+)=c(OH﹣)
)>c(H+)=c(OH﹣)
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO
 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式
第一步水解的离子方程式 第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO ):c(CO
):c(CO )=20:1 时,溶液的pH=
)=20:1 时,溶液的pH=②泡沫灭火器中通常装有NaHCO溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmol•L﹣1CH3COONa溶液,则两份溶液中c(NO
 )、c(NO
)、c(NO )和c(CH3COO﹣)由大到小的顺序为
)和c(CH3COO﹣)由大到小的顺序为A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收吸收SO2的过裎中,溶液中H2SO3、HSO
 、SO
、SO 三者所占物质的量分数(a)随pH变化的关系如图所示:
三者所占物质的量分数(a)随pH变化的关系如图所示:
图中pH=7时,溶液中离子浓度关系正确的是
A.c(Na+)>2c(SO
 )>c(HSO
)>c(HSO )
)B.c(Na+)=c(SO
 )+c(HSO
)+c(HSO )+c(H2SO3)
)+c(H2SO3)C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO
 )
)D.c(Na+)>c(HSO
 )>c(SO
)>c(SO )>c(H+)=c(OH﹣)
)>c(H+)=c(OH﹣)
您最近一年使用:0次
3 . CH3COOH、HClO、H2CO3 是中学化学常见的弱酸,其电离平衡常数如表所示。
回答下列问题:
(1)土壤的 pH 一般在 4~9 之间。但土壤中 Na2CO3 含量较高时,pH 可高达 10.5,可喷洒___________ 以调节土壤的 pH。
A.水 B.NH4Cl 溶液 C.NaCl 溶液 D. CaCl2 溶液
(2)向 NaClO 溶液中通入少量 CO2 的化学方程式为___________ 。
(3)常温下在 20 mL 0.1 mol·L-1Na2CO3 溶液中逐滴加入0.1 mol·L-1HCl 溶液 40 mL,溶液中含碳元素的各种微粒(CO2 因逸出未画出)物质的量分数(纵轴)随溶液pH 变化的部分情况如图所示。
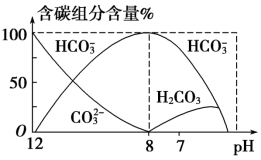
①在同一溶液中,H2CO3、 、
、
___________ (填“能”或“不能”)大量共存。
②pH= 7 时,溶液中可测出其含量的含碳元素的微粒为___________ ,溶液中各种离 子的浓度大小关系为___________ 。
③溶液中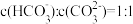 时,溶液的 pH=
时,溶液的 pH=___________ (保留小数后两位,已知 lg4.4=0.64,lg4.7=0.67)。
| 酸 | CH3COOH | HClO | H2CO3 |
电离平衡常数(常温) | K= 1.8×10-5 | K= 3.0×10-8 | K1= 4.4×10-7 K2= 4.7×10-11 |
回答下列问题:
(1)土壤的 pH 一般在 4~9 之间。但土壤中 Na2CO3 含量较高时,pH 可高达 10.5,可喷洒
A.水 B.NH4Cl 溶液 C.NaCl 溶液 D. CaCl2 溶液
(2)向 NaClO 溶液中通入少量 CO2 的化学方程式为
(3)常温下在 20 mL 0.1 mol·L-1Na2CO3 溶液中逐滴加入0.1 mol·L-1HCl 溶液 40 mL,溶液中含碳元素的各种微粒(CO2 因逸出未画出)物质的量分数(纵轴)随溶液pH 变化的部分情况如图所示。

①在同一溶液中,H2CO3、
 、
、
②pH= 7 时,溶液中可测出其含量的含碳元素的微粒为
③溶液中
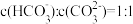 时,溶液的 pH=
时,溶液的 pH=
您最近一年使用:0次
4 . 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol/LNaCN溶液和0.1mol/LCH3COONa溶液中,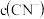
______ 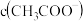 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
②常温下,物质的量浓度相同的三种溶液:A. CH3COONa B. NaCN C. Na2CO3,其pH由大到小的顺序是______ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是______ 。
④室温下,一定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______ ,溶液中c(CH3COO-)/c(CH3COOH) =______ 。
(2)常温下,向20.00mL0.1000mol/L的醋酸溶液中逐滴加入0.1000mol/L的NaOH溶液,pH值随NaOH溶液体积的变化如图所示。

①d点(NaOH溶液为20mL时)所示的溶液中离子浓度由大到小的顺序依次为______ 。
②b点所示的溶液中c(CH3COO-)-c(CH3COOH)=______ (写表达式)。
(1)已知部分弱酸的电离常数如表:
| 弱酸 |  |  |  |
| 电离常数(25℃) |  | 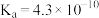 | 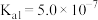 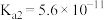 |
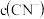
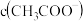 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②常温下,物质的量浓度相同的三种溶液:A. CH3COONa B. NaCN C. Na2CO3,其pH由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,一定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
(2)常温下,向20.00mL0.1000mol/L的醋酸溶液中逐滴加入0.1000mol/L的NaOH溶液,pH值随NaOH溶液体积的变化如图所示。

①d点(NaOH溶液为20mL时)所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(CH3COO-)-c(CH3COOH)=
您最近一年使用:0次
名校
5 . 下表是几种常见弱酸的电离平衡常数(25℃)
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HCN三种酸的酸性最强的是______ ,相同浓度的Na2CO3、CH3COONa、NaCN溶液pH最大的是______ 。
(2)常温下一定浓度的NaCN溶液pH=9,溶液中c(OH-)=______ ,用离子方程式表示NaCN溶液呈碱性的原因______ 。
(3)向NaCN溶液中通入少量CO2,反应的离子方程式是______ 。
(4)25℃时,某HCN和NaCN的混合液的pH=8,则溶液中c(HCN)与c(CN-)之比是______ ,该条件下NaCN的水解常数为______ 。(保留两位有效数字)
(5)实验室用酸碱中和滴定法测定某市售白醋的浓度
I.实验步骤
①配制待测白醋溶液
②量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂
③读取盛装0.1000 mol·L-1 NaOH溶液的碱式滴定管的初始读数
④滴定,判断滴定终点的现象是______ ,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3次。
II.实验记录
III.数据处理与讨论
⑤甲同学在处理数据时计算得:c(市售白醋)=______ mol·L-1。
⑥碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______ (填“偏小”“偏大”或“无影响”)。
| 化学式 | H2CO3 | CH3COOH | HCN |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 1.8×10-5 | 5.0×10-10 |
(2)常温下一定浓度的NaCN溶液pH=9,溶液中c(OH-)=
(3)向NaCN溶液中通入少量CO2,反应的离子方程式是
(4)25℃时,某HCN和NaCN的混合液的pH=8,则溶液中c(HCN)与c(CN-)之比是
(5)实验室用酸碱中和滴定法测定某市售白醋的浓度
I.实验步骤
①配制待测白醋溶液
②量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂
③读取盛装0.1000 mol·L-1 NaOH溶液的碱式滴定管的初始读数
④滴定,判断滴定终点的现象是
II.实验记录
| 实验数据(mL)/滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
⑤甲同学在处理数据时计算得:c(市售白醋)=
⑥碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
您最近一年使用:0次
6 . I.糖类是人体基本营养物质,在试管中加入0.5g淀粉和4mL20%的硫酸,加热3min~4min。请回答下列问题:
(1)淀粉完全水解生成的有机物分子式为______
(2)若要检验淀粉已经发生了水解,操作方法及实验现象为______ 。
(3)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
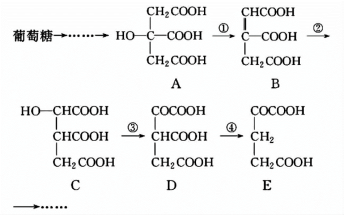
过程①是______ 反应,过程③是______ 反应(填反应类型);上述物质中,互为同分异构体的是______ (填字母代号)。
II.海水是重要的物质资源宝库,海水pH稳定在7.9-8.4之间,可用于烟道气中SO2的吸收。
(1)已知:25℃时,
H2CO3电离平衡常数K1 =4.3×10-7 K2=5. 6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10 -8
海水中含有的HCO 可用于吸收SO2,该过程的离子方程式是
可用于吸收SO2,该过程的离子方程式是______ 。
(2)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是______
②上述方式使处理后海水pH升高的原因是______
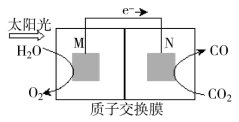
(3)科学家还研究了转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为______
(1)淀粉完全水解生成的有机物分子式为
(2)若要检验淀粉已经发生了水解,操作方法及实验现象为
(3)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:

过程①是
II.海水是重要的物质资源宝库,海水pH稳定在7.9-8.4之间,可用于烟道气中SO2的吸收。
(1)已知:25℃时,
H2CO3电离平衡常数K1 =4.3×10-7 K2=5. 6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10 -8
海水中含有的HCO
 可用于吸收SO2,该过程的离子方程式是
可用于吸收SO2,该过程的离子方程式是(2)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是
②上述方式使处理后海水pH升高的原因是
(3)科学家还研究了转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为

您最近一年使用:0次
7 . 下列溶液中,导电性最强的是
| A.5L0.1mol/L氨水 | B.5L0.1mol/L盐酸 |
| C.0.1L0.1mol/LBa(OH)2溶液 | D.0.1L0.1mol/L醋酸溶液 |
您最近一年使用:0次
解题方法
8 . 根据所学知识回答下列问题:
(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为______________ 。
(2)已知:常温时,亚硫酸的电离平衡常数Ka1=1.23×10-2,Ka2=5.60×10-8,则0.1 mol·L-1的NaHSO3溶液显_______ (填“酸”、“中”或“碱”)性,请用相应的数据及文字说明:______________ 。
(3)实验室用FeCl3(s)配制FeCl3溶液的操作为_______ ,若将FeCl3溶液蒸干并灼烧至恒重,得到的物质为_______ (填化学式)。
(4)25℃时,将足量氯化银分别放入下列4种溶液中,充分搅拌后,银离子浓度由大到小的顺序是_______ (填标号);②中氯离子的浓度为_______ mol·L-1.(氯化银的Ksp=1.8×10-10)
①100 mL蒸馏水 ②100 mL 0.2 mol·L-1 AgNO3溶液
③100 mL 0.1 mol·L-1 氯化铝溶液 ④100 mL 0.1 mol·L-1盐酸
(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为
(2)已知:常温时,亚硫酸的电离平衡常数Ka1=1.23×10-2,Ka2=5.60×10-8,则0.1 mol·L-1的NaHSO3溶液显
(3)实验室用FeCl3(s)配制FeCl3溶液的操作为
(4)25℃时,将足量氯化银分别放入下列4种溶液中,充分搅拌后,银离子浓度由大到小的顺序是
①100 mL蒸馏水 ②100 mL 0.2 mol·L-1 AgNO3溶液
③100 mL 0.1 mol·L-1 氯化铝溶液 ④100 mL 0.1 mol·L-1盐酸
您最近一年使用:0次
9 . 已知:硫酸、硒酸、亚磷酸等是二元酸。请根据所给信息完成下列问题。
(1)硒酸(H2SeO4)在水溶液中的电离如下: ,
, ,
,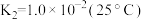 。
。
①向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为___________ 。
②已知 的电离平衡常数
的电离平衡常数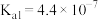 ,
, ,则
,则 和
和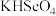 两溶液混合反应的离子方程式为:
两溶液混合反应的离子方程式为:___________ 。
(2)亚磷酸( )是二元弱酸,已知常温下
)是二元弱酸,已知常温下 的电离常数的值:
的电离常数的值: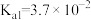 ,
, 。则
。则 溶液显
溶液显___________ 性。(选填“酸”、“碱”或“中”)
(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸( )具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:
)具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为: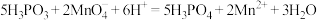 。
。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:___________ 。
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为______  。(保留小数点后两位)
。(保留小数点后两位)
(4)某研究性学习小组在实验室中配制 的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___________ 。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
(1)硒酸(H2SeO4)在水溶液中的电离如下:
 ,
, ,
,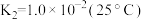 。
。①向
 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为②已知
 的电离平衡常数
的电离平衡常数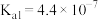 ,
, ,则
,则 和
和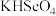 两溶液混合反应的离子方程式为:
两溶液混合反应的离子方程式为:(2)亚磷酸(
 )是二元弱酸,已知常温下
)是二元弱酸,已知常温下 的电离常数的值:
的电离常数的值: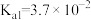 ,
, 。则
。则 溶液显
溶液显(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(
 )具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:
)具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为: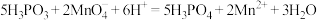 。
。①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为
 。(保留小数点后两位)
。(保留小数点后两位)| 试验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
(4)某研究性学习小组在实验室中配制
 的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
您最近一年使用:0次
解题方法
10 . 已知在25℃时,醋酸、氢氰酸和氢硫酸的电离平衡常数如表:
请回答下列问题:
(1)写出H2S的第二步电离平衡常数表达式Ka2=___ 。
(2)相同条件下,CH3COO-、CN-、HS-中结合H+能力最强的是__ 。
(3)如图表示25℃时稀释CH3COOH、HCN的稀溶液,溶液pH随溶液体积的变化图象:

①曲线Ⅰ表示的酸是__ (填化学式)。
②A、B、C三点中,溶液的导电能力最强的是__ (填字母)。
(4)25℃时,pH相同的CH3COONa溶液和NaCN溶液,其物质的量浓度的关系是:c(CH3COONa)__ c(NaCN)(填“>”“<”或“=”)。
(5)25℃时,下列关于NaHS和Na2S的说法正确的是__ (填序号)。
A.NaHS溶液呈碱性
B.NaHS溶液中存在:c(HS-)+c(OH-)=c((Na+)+c(H+)
C.Na2S溶液中加入少量NaOH固体,Na2S的水解程度增大
D.Na2S溶液与AlCl3溶液混合,有气体和沉淀生成
(6)在工业废水处理中可以用Na2S作沉淀剂,将Cu2+转化为CuS除去。常温下,Ksp(CuS)=6.3×10-36,向c(Cu2+)=0.030mol/L的废水中加入Na2S固体(溶液体积无变化),当Cu2+刚开始沉淀时,废水中的c(S2-)=__ mol/L。
| CH3COOH | HCN | H2S |
| Ka=1.75×10-5 | Ka=6.2×10-10 | Ka1=1.1×10-7 Ka2=1.3×10-13 |
请回答下列问题:
(1)写出H2S的第二步电离平衡常数表达式Ka2=
(2)相同条件下,CH3COO-、CN-、HS-中结合H+能力最强的是
(3)如图表示25℃时稀释CH3COOH、HCN的稀溶液,溶液pH随溶液体积的变化图象:

①曲线Ⅰ表示的酸是
②A、B、C三点中,溶液的导电能力最强的是
(4)25℃时,pH相同的CH3COONa溶液和NaCN溶液,其物质的量浓度的关系是:c(CH3COONa)
(5)25℃时,下列关于NaHS和Na2S的说法正确的是
A.NaHS溶液呈碱性
B.NaHS溶液中存在:c(HS-)+c(OH-)=c((Na+)+c(H+)
C.Na2S溶液中加入少量NaOH固体,Na2S的水解程度增大
D.Na2S溶液与AlCl3溶液混合,有气体和沉淀生成
(6)在工业废水处理中可以用Na2S作沉淀剂,将Cu2+转化为CuS除去。常温下,Ksp(CuS)=6.3×10-36,向c(Cu2+)=0.030mol/L的废水中加入Na2S固体(溶液体积无变化),当Cu2+刚开始沉淀时,废水中的c(S2-)=
您最近一年使用:0次



