名校
1 . 常温下,取三份浓度均为 体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为
体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为 的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示
的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示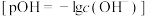 。
。
 体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为
体积均为20mL的醋酸钠溶液,分别向其中滴加浓度均为 的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示
的氯化铵溶液、醋酸铵溶液和盐酸,滴加过程中溶液的pOH变化曲线如图所示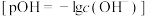 。
。
| A.曲线Ⅰ、Ⅱ、Ⅲ分别代表盐酸、氯化铵溶液和醋酸铵溶液 |
B.常温下 |
C.水的电离程度: |
D.d点存在: |
您最近一年使用:0次
7日内更新
|
67次组卷
|
2卷引用:河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题
名校
2 . 实验室模拟侯氏制碱碳酸化制NaHCO3的过程,将CO2通入饱和氨盐水(溶质为NH3、NaCl),实验现象及数据如图1,含碳粒子在水溶液中的物质的量分数(δ)与pH的关系如图2。
下列说法正确的是

下列说法正确的是
A.0min,溶液中 |
B.0~60min,发生反应:CO2 +2NH3•H2O = 2NH +CO +CO + H2O + H2O |
| C.水的电离程度:0min>60min |
| D.0-100min,n(Na+)减小、n(Cl-)保持不变 |
您最近一年使用:0次
名校
3 . 已知室温时: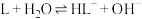
 。化合物L与
。化合物L与 形成配合物(
形成配合物(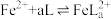 ),
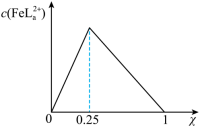
),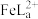 的浓度随
的浓度随 的投料百分比的变化如图所示(
的投料百分比的变化如图所示(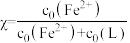 ,
, 表示初始浓度)。
表示初始浓度)。
下列说法错误的是
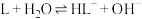
 。化合物L与
。化合物L与 形成配合物(
形成配合物(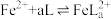 ),
),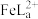 的浓度随
的浓度随 的投料百分比的变化如图所示(
的投料百分比的变化如图所示(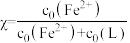 ,
, 表示初始浓度)。
表示初始浓度)。下列说法错误的是
A.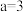 |
B.25℃时, 的L溶液pH≈5 的L溶液pH≈5 |
C.增大pH有利于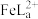 的生成 的生成 |
D.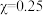 的溶液中, 的溶液中,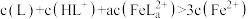 |
您最近一年使用:0次
名校
解题方法
4 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是| A.1molCaC2晶体和1molCaH2晶体含有的离子数目均为2NA |
| B.1molFe与水蒸气在高温下充分反应,转移的电子数为3NA |
C.35℃时,1LpH=5的NH4NO3溶液中,水电离出的 数等于10-5NA 数等于10-5NA |
| D.电解精炼铜时,阳极质量减少64g,电路中转移电子数不可能是2NA |
您最近一年使用:0次
解题方法
5 . 某小组同学探究盐对 平衡体系的影响。
平衡体系的影响。
实验I:探究 对
对 和
和 平衡体系的影响
平衡体系的影响
将等体积、低浓度的
 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和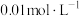
 溶液混合,静置至体系达平衡,得红色溶液
溶液混合,静置至体系达平衡,得红色溶液 。各取3mL溶液
。各取3mL溶液 放入3只比色皿中,分别滴加0.1mL不同浓度的
放入3只比色皿中,分别滴加0.1mL不同浓度的 溶液,并测定各溶液的透光率随时间的变化,结果如下图。
溶液,并测定各溶液的透光率随时间的变化,结果如下图。
② 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。
(1)稀盐酸酸化 溶液的目的是
溶液的目的是___________ 。采用浓度较低的 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看, 溶液确实对
溶液确实对 和
和 平衡体系有影响,且随着
平衡体系有影响,且随着 浓度增大,
浓度增大, 平衡向
平衡向___________ (填“正”或“逆”)反应方向移动。
实验Ⅱ:探究盐对 和
和 平衡体系产生影响的原因
平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。 溶液的加入使
溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液 ,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
①上述实验可证明盐效应影响了 和
和 平衡体系的是
平衡体系的是___________ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验___________ (填序号)可得出结论: 的盐效应弱于
的盐效应弱于 的盐效应。简述选择实验的理由及获得结论的依据:
的盐效应。简述选择实验的理由及获得结论的依据:___________ 。
(4)取等体积的溶液 继续进行实验,结果如下表。
继续进行实验,结果如下表。
上述实验可证明副反应影响了 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:___________ 。
 平衡体系的影响。
平衡体系的影响。实验I:探究
 对
对 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的

 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和
 溶液混合,静置至体系达平衡,得红色溶液
溶液混合,静置至体系达平衡,得红色溶液 。各取3mL溶液
。各取3mL溶液 放入3只比色皿中,分别滴加0.1mL不同浓度的
放入3只比色皿中,分别滴加0.1mL不同浓度的 溶液,并测定各溶液的透光率随时间的变化,结果如下图。
溶液,并测定各溶液的透光率随时间的变化,结果如下图。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,
 溶液确实对
溶液确实对 和
和 平衡体系有影响,且随着
平衡体系有影响,且随着 浓度增大,
浓度增大, 平衡向
平衡向实验Ⅱ:探究盐对
 和
和 平衡体系产生影响的原因
平衡体系产生影响的原因同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
 溶液的加入使
溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液
 ,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。| 序号 | 加入少量盐溶液 | 颜色 |
| 1 | 无 | 红色 |
| 2 |  | 变浅 |
| 3 |  | 略变浅 |
| 4 |  | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。简述选择实验的理由及获得结论的依据:
的盐效应。简述选择实验的理由及获得结论的依据:(4)取等体积的溶液
 继续进行实验,结果如下表。
继续进行实验,结果如下表。| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:
您最近一年使用:0次
6 . 25℃时, 的电离常数
的电离常数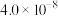 ,
, 的电离常数
的电离常数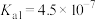 、
、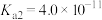 。下列说法不正确的是
。下列说法不正确的是
 的电离常数
的电离常数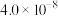 ,
, 的电离常数
的电离常数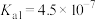 、
、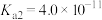 。下列说法不正确的是
。下列说法不正确的是A. 溶液和 溶液和 溶液中离子种类相同 溶液中离子种类相同 |
B.25℃时,反应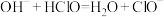 的 的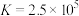 |
C.25℃,物质的量浓度相同的 溶液与 溶液与 溶液的 溶液的 :前者小于后者 :前者小于后者 |
D.向氯水中加入少量 固体, 固体, 增大,向 增大,向 溶液中通入过量 溶液中通入过量 ,反应的离子方程式为: ,反应的离子方程式为: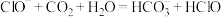 |
您最近一年使用:0次
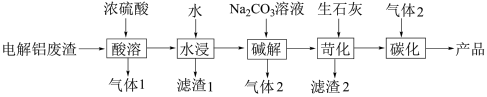
7 . 碳酸锂可以用作电池的正极材料。在锂离子电池中,正极材料是决定电池性能的关键因素之一,而碳酸锂能够有效提高电池的能量密度和稳定性,从而延长电池的使用寿命。这使得碳酸锂成为制造高性能电动汽车电池和储能系统的重要材料。以电解铝废渣(主要含AlF3、NaF、LiF、CaO)为原料,制备电池级碳酸锂的工艺流程如下: 、
、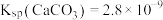 。回答下列问题:
。回答下列问题:
(1)①电解氧化铝生成铝的化学方程式为__________ ,无碳电解铝技术是利用陶瓷材料替代碳作阳极,该技术的优点之一是__________ 。
②已知AlCl3可形成共价分子,AlF3为离子晶体,从电负性的角度解释其原因:__________ 。
(2)“气体1”是______ (填化学式,下同),“滤渣1”的主要成分是______ 。
(3)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式__________________ 。
(4)Al-Li合金具有低密度、耐腐蚀等特点,已成为航天器的重要结构材料。一种Al3Li合金的晶胞如图所示,其中白球代表的是______ ;若其晶胞参数为apm,则该合金的晶体密度为______ g∙cm-3(列出计算式,阿伏加德罗常数用NA表示)。
 、
、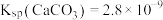 。回答下列问题:
。回答下列问题:(1)①电解氧化铝生成铝的化学方程式为
②已知AlCl3可形成共价分子,AlF3为离子晶体,从电负性的角度解释其原因:
(2)“气体1”是
(3)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式
(4)Al-Li合金具有低密度、耐腐蚀等特点,已成为航天器的重要结构材料。一种Al3Li合金的晶胞如图所示,其中白球代表的是

您最近一年使用:0次
解题方法
8 . 已知:25℃时,二元弱酸 的
的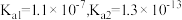 ;氢氧化铁的
;氢氧化铁的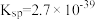 、氢氧化锌的
、氢氧化锌的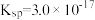 、硫化锌的
、硫化锌的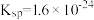 。下列有关说法正确的是
。下列有关说法正确的是
 的
的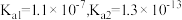 ;氢氧化铁的
;氢氧化铁的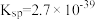 、氢氧化锌的
、氢氧化锌的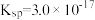 、硫化锌的
、硫化锌的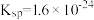 。下列有关说法正确的是
。下列有关说法正确的是A. 溶液中 溶液中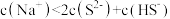 |
B. 饱和溶液中的 饱和溶液中的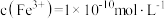 |
C.分别向等体积等浓度的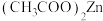 、 、 溶液中通入等物质的量的 溶液中通入等物质的量的 沉淀 沉淀 后,前者 后,前者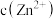 更大 更大 |
D.向等物质的量浓度的 与 与 混合液中逐滴加入 混合液中逐滴加入 溶液,先产生 溶液,先产生 沉淀 沉淀 |
您最近一年使用:0次
9 . 类推是化学学习和研究中常用的思维方法,下列推测不合理的是
| 选项 | 事实 | 推测 |
| A | 乳酸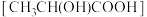 分子有对映异构体 分子有对映异构体 | 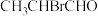 也有对映异构体 也有对映异构体 |
| B | 键角大小: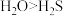 | 键角大小: |
| C | 第一电离能大小: | 第一电离能大小: |
| D | 在相同条件下,水解能力: | 在相同条件下,水解能力: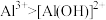 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 根据下列实验目的,对应的实验操作、实验现象和结论都正确的是
| 选项 | 实验目的 | 实验操作 | 实验现象和结论 |
| A | 探究钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入 蒸馏水 蒸馏水 | 若无气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 |
| B | 探究浓硫酸的性质 | 加热浓硫酸、 固体与 固体与 固体的混合物 固体的混合物 | 有黄绿色气体产生,证明浓硫酸具有强氧化性 |
| C | 探究麦芽糖的水解情况 | 向麦芽糖溶液中滴加稀硫酸,水浴加热,再加入 溶液至碱性,加入新制的 溶液至碱性,加入新制的 悬浊液,加热 悬浊液,加热 | 有砖红色沉淀产生,则可说明麦芽糖已发生水解 |
| D | 验证 和 和 的水解能力 的水解能力 | 将 液体和 液体和 固体分别暴露在潮湿空气中 固体分别暴露在潮湿空气中 | 只有前者会冒“白烟”,则水解能力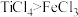 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



