名校
1 . 根据实验操作及现象,下列结论中正确的是
| 实验目的 | 方案设计和现象 | 结论 | |
| A | 比较KMnO4、Cl2和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性:KMnO4>Cl2>Fe3+ |
| B | 比较Ksp(AgCl)、Ksp(AgI)的大小 | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| C | 检验海带中是否含有碘元素 | 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量双氧水,充分反应后加入1-2滴淀粉溶液 | 溶液变蓝,则证明海带中含有碘元素 |
| D | 温度对SO 水解平衡的影响 水解平衡的影响 | 将25℃0.1mol•L-1Na2SO3溶液加热到40℃,用传感器监测溶液pH变化 | pH变小,温度升高,SO 的水解平衡正向移动 的水解平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-11更新
|
186次组卷
|
2卷引用:四川省成都外国语学校2023-2024学年高三上学期期末考试理科综合试题-高中化学
2 . 向三份0.1mol/L  溶液中分别加入少量
溶液中分别加入少量 、
、 、
、 固体(忽略溶液体积变化),则
固体(忽略溶液体积变化),则 浓度的变化依次为
浓度的变化依次为
 溶液中分别加入少量
溶液中分别加入少量 、
、 、
、 固体(忽略溶液体积变化),则
固体(忽略溶液体积变化),则 浓度的变化依次为
浓度的变化依次为| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
您最近一年使用:0次
名校
3 . 在日常生产生活中,经常涉及化学反应原理,下列过程或现象与盐类水解无关的是
| A.加热氯化铁溶液,颜色变深 |
B. 与 与 溶液可用作焊接金属时的除锈剂 溶液可用作焊接金属时的除锈剂 |
| C.氯化钙溶液中滴加甲基橙,溶液显黄色 |
D.实验室中盛放 溶液的试剂瓶不能用磨口玻璃塞 溶液的试剂瓶不能用磨口玻璃塞 |
您最近一年使用:0次
2024-03-09更新
|
185次组卷
|
2卷引用:安徽省合肥市第一中学2023-2024学年高二上学期期末考试化学试题
名校
4 . 无水氯化铁,在空气中极易潮解,加热易升华,常应用于金属蚀刻和污水处理。某化学兴趣小组设计如下实验制备无水氯化铁,并进行其性质探究。回答下列问题:
I.无水氯化铁的制备
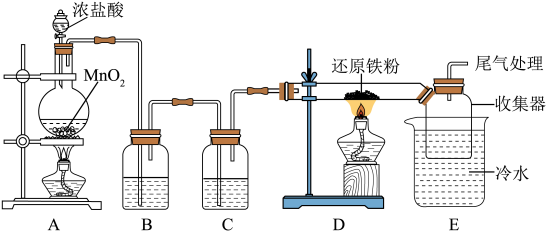
(1)盛装浓盐酸的仪器名称是_______ ,装置B中盛装的药品是_______ ,装置C的作用是_______ 。
(2)装置D中发生反应的化学方程式为_______ 。
(3)装置D、E之间用大口径玻璃管连接的原因是_______ 。
Ⅱ.氯化铁性质探究
(4)取收集器中固体配制成 溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和
溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和_______ 配制溶液时,应先将氯化铁固体溶于较浓的盐酸中,盐酸的作用是_______ 。
(5)向甲、乙两支试管中分别加入 溶液,向甲试管中滴加
溶液,向甲试管中滴加 溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加
溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加
溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加 溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加
溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。
溶液,溶液颜色加深,放置一小时后溶液变为绿色。
①甲试管中产生沉淀的化学式为_______ ,利用平衡移动原理解释产生该沉淀的原因:_______ 。
②甲、乙两支试管中最终溶液都变为绿色,发生反应的离子方程式为_______ 。
I.无水氯化铁的制备

(1)盛装浓盐酸的仪器名称是
(2)装置D中发生反应的化学方程式为
(3)装置D、E之间用大口径玻璃管连接的原因是
Ⅱ.氯化铁性质探究
(4)取收集器中固体配制成
 溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和
溶液。所需的玻璃仪器主要有量筒、玻璃棒、烧杯、胶头滴管和(5)向甲、乙两支试管中分别加入
 溶液,向甲试管中滴加
溶液,向甲试管中滴加 溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加
溶液,试管中溶液由黄色变为红褐色,并有沉淀生成,振荡后沉淀消失,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加
溶液,溶液颜色加深,放置一小时后溶液变为绿色。向乙试管中滴加 溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加
溶液,试管中溶液由黄色变为红褐色,没有沉淀生成,继续滴加 溶液,溶液颜色加深,放置一小时后溶液变为绿色。
溶液,溶液颜色加深,放置一小时后溶液变为绿色。①甲试管中产生沉淀的化学式为
②甲、乙两支试管中最终溶液都变为绿色,发生反应的离子方程式为
您最近一年使用:0次
2024-03-02更新
|
110次组卷
|
2卷引用:湖北省恩施州高中教育联盟2023-2024学年高二上学期期末考试化学试题
名校
解题方法
5 . 下列操作能达到相应实验目的的是
| 实验操作 | 实验目的 | |
| A | 向等体积、等pH的两种酸溶液HA和HB中分别加入足量锌粉,充分反应后,HA溶液产生更多的氢气 | 说明Ka(HA)>Ka(HB) |
| B | 向5mL0.1mol/LCuSO4溶液中先加入2mL0.4mol/LNaOH溶液,再加入1mL0.1mol/LNa2S溶液 | 探究常温下Ksp[Cu(OH)2]>Ksp(CuS) |
| C | 向滴有酚酞的碳酸钠溶液中加入适量BaCl2固体,溶液颜色变浅 | 说明碳酸钠溶液中存在水解平衡 |
| D | 向2支盛有5mL不同浓度NaHSO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-27更新
|
381次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高二上学期期末考试化学试题
名校
解题方法
6 . “吃饺子要蘸醋”是很多中国人传统的饮食习惯,我们对醋酸的使用有着悠久的历史。
(1) 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
_______ (填“>”“<”或“=”)所得盐酸的 。
。
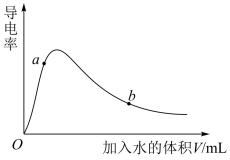
(2)取 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
①由水电离出的氢离子 :a
:a_______ b(填“>”“<”或“=”)。
②使图中b点对应的溶液中 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是_______ (填标号)。
A.加入 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体
(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ;判断 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为_______ 。
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石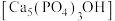 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:_______ [已知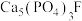 难溶于酸]。
难溶于酸]。
(5)常温下,某同学取 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为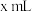 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
_______ (用含x的代数式表示)。

(1)
 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
 。
。(2)取
 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。①由水电离出的氢离子
 :a
:a②使图中b点对应的溶液中
 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是A.加入
 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知
 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式: 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为| 弱酸 |  |  |  |
| 电离平衡常数 | 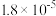 | 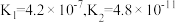 | 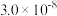 |
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石
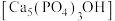 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因: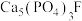 难溶于酸]。
难溶于酸]。(5)常温下,某同学取
 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为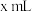 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
您最近一年使用:0次
2024-02-26更新
|
123次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 亚硫酸钠( )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
实验(一)探究 水解的影响因素。
水解的影响因素。
I.配制250 mL 0.1 mol⋅L
 溶液。
溶液。
(1)称取 固体的质量为
固体的质量为______ g。
(2)配制该溶液不需要选择下列仪器中的______ (填标号)。
(3)实验①④_______ (填“能”或“不能”)得出单一变量对实验结果的影响规律。
(4)实验①和②的目的是___________ 。
(5)某同学预测 ,实验测得
,实验测得 ,
,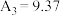 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是_______ (答1条);将实验③的溶液降温至25℃(标记为⑤),测得溶液pH为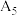 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:_______ ,设计实验证明你的猜想:________ ,猜想成立。
实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L
 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。
(6)该 样品纯度为
样品纯度为______ %,若滴定前仰视读数,滴定终点俯视读数,则测得的结果______ (填“偏高”“偏低”或“无影响”)。
 )常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:
)常作抗氧化剂、稳定剂和漂白剂。某小组拟对亚硫酸钠展开探究,回答下列问题:实验(一)探究
 水解的影响因素。
水解的影响因素。I.配制250 mL 0.1 mol⋅L

 溶液。
溶液。(1)称取
 固体的质量为
固体的质量为(2)配制该溶液不需要选择下列仪器中的
A. B.
B. C.
C.
| 序号 | 0.1 mol⋅L  溶液 /mL 溶液 /mL | 水/mL | 水浴温度/℃ | 测得pH |
| ① | 10.0 | 0 | 25 | 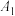 |
| ② | 5.0 | 5 | 25 | 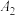 |
| ③ | 10.0 | 0 | 40 |  |
| ④ | 8.0 | 2 | 35 |  |
(3)实验①④
(4)实验①和②的目的是
(5)某同学预测
 ,实验测得
,实验测得 ,
,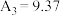 ,理论预测与实际矛盾的原因可能是
,理论预测与实际矛盾的原因可能是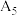 (9.25),小于
(9.25),小于 (9.66),请你猜想可能的原因:
(9.66),请你猜想可能的原因:实验(二)测定样品纯度。
称取w g 样品溶于水配制成100 mL溶液,准确量取25.00 mL制得的溶液于锥形瓶中,滴加2滴淀粉溶液,用标准c mol⋅L

 溶液滴定至终点,消耗滴定液的体积为V mL。
溶液滴定至终点,消耗滴定液的体积为V mL。(6)该
 样品纯度为
样品纯度为
您最近一年使用:0次
2024-02-03更新
|
120次组卷
|
4卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
名校
8 . 关于下列常温下的水溶液的说法正确的是
A.向水中加入 溶液仍显中性,水的电离平衡不移动 溶液仍显中性,水的电离平衡不移动 |
B.加水稀释亚硫酸( )溶液, )溶液, 始终不变 始终不变 |
| C.将pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液呈中性 |
D.相同 的溶质的物质的量浓度: 的溶质的物质的量浓度: |
您最近一年使用:0次
2024-02-01更新
|
229次组卷
|
3卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
解题方法
9 . 铋酸钠(NaBiO3)在酸性条件下可将Mn2+氧化成MnO ,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
 ,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是| A.常温下,NaBiO3和Bi(NO3)3均可溶于水 |
B.制备NaBiO3的化学方程式为Bi(NO3)3+4NaOH+NaClO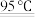 NaBiO3↓+NaCl+3NaNO3+2H2O NaBiO3↓+NaCl+3NaNO3+2H2O |
| C.将Bi(NO3)3溶解于稀HNO3溶液中的目的是增强酸性 |
| D.用NaBiO3分析测定锰元素的过程中,NaBiO3发生氧化反应 |
您最近一年使用:0次
2023-08-15更新
|
471次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
解题方法
10 . 一定温度下,0.1mol·L-1Na2CO3水溶液中存在水解平衡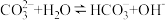 ,下列说法错误的是
,下列说法错误的是
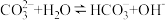 ,下列说法错误的是
,下列说法错误的是| A.通入CO2,溶液pH减小 | B.升高温度,该水解平衡常数增大 |
C.加入NaOH固体, 减小 减小 | D.稀释溶液, 减小 减小 |
您最近一年使用:0次



