解题方法
1 . 研究发现,在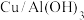 催化剂上使用等离子体催化能将
催化剂上使用等离子体催化能将 和
和 直接转化为
直接转化为 和
和 。某小组以硫酸烧渣(主要成分为
。某小组以硫酸烧渣(主要成分为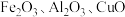 和
和 等)制备
等)制备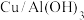 催化剂的流程如图所示:
催化剂的流程如图所示:
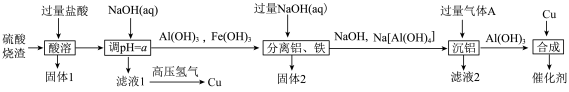
几种金属离子沉淀的pH如表所示:
回答下列问题:
(1)灼烧固体2得到的主要成分是___________ (填化学式)。气体A是_________ (填名称)。
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度,其原因是____________________ 。a的范围为____________________ 。
(3)滤液1中通入高压氢制备铜的离子方程式为_______________________ 。
(4)滤液2的pH__________________ (填“>”“<”或“=”)7。
(5)该催化剂能将 和
和 转化成
转化成 、
、 ,这四种分子中能与水分子形成氢键的有
,这四种分子中能与水分子形成氢键的有______________________ (填化学式)。
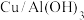 催化剂上使用等离子体催化能将
催化剂上使用等离子体催化能将 和
和 直接转化为
直接转化为 和
和 。某小组以硫酸烧渣(主要成分为
。某小组以硫酸烧渣(主要成分为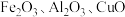 和
和 等)制备
等)制备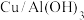 催化剂的流程如图所示:
催化剂的流程如图所示:
几种金属离子沉淀的pH如表所示:
| 金属离子 |  |  |  |
| 开始沉淀pH | 1.9 | 3.4 | 7.4 |
| 完全沉淀pH | 3.7 | 4.7 | 9.6 |
(1)灼烧固体2得到的主要成分是
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度,其原因是
(3)滤液1中通入高压氢制备铜的离子方程式为
(4)滤液2的pH
(5)该催化剂能将
 和
和 转化成
转化成 、
、 ,这四种分子中能与水分子形成氢键的有
,这四种分子中能与水分子形成氢键的有
您最近一年使用:0次
名校
2 . 化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.影响化学平衡的因素
 溶液中存在平衡:
溶液中存在平衡: (蓝色)
(蓝色)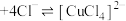 (黄色)
(黄色)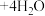
(1)取两支试管,分别加入2 mL 0.5 mol/L 溶液,溶液呈绿色,其原因为
溶液,溶液呈绿色,其原因为____________ 。
(2)将其中一支试管加热,溶液变为黄绿色,则该反应的
______ 0(填“>”或“<”),在另一支试管中加入5滴 溶液,静置,上层清液呈
溶液,静置,上层清液呈______ 色。
Ⅱ.电离平衡常数
(3) 是二元弱酸,其电离平衡常数
是二元弱酸,其电离平衡常数 的表达式为
的表达式为______ 。
(4)向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L 溶液,观察到试管中有气泡产生,由此推断的
溶液,观察到试管中有气泡产生,由此推断的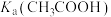
______ 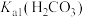 (填“>”或“<”),发生反应的离子方程式为
(填“>”或“<”),发生反应的离子方程式为____________ 。
Ⅲ.盐类水解的应用
(5)向一支试管中加入少量 晶体,然后加入5 mL蒸馏水、振荡,观察到
晶体,然后加入5 mL蒸馏水、振荡,观察到 慢慢溶解,但有少量浑浊,此溶液的pH
慢慢溶解,但有少量浑浊,此溶液的pH______ 7(填“>”“<”或“=”),配制 溶液的正确方法是
溶液的正确方法是____________ 。
(6)向一个烧杯中加入40 mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和 溶液,继续煮沸制得
溶液,继续煮沸制得 胶体。该反应的化学方程式为
胶体。该反应的化学方程式为____________ , 胶体呈
胶体呈______ 色。
Ⅳ.亚铁离子的检验
(7) 与
与______ 色的 溶液反应有特征蓝色沉淀产生,这是检验溶液中
溶液反应有特征蓝色沉淀产生,这是检验溶液中 的常用方法。写出该反应的离子方程式:
的常用方法。写出该反应的离子方程式:____________ 。
Ⅰ.影响化学平衡的因素
 溶液中存在平衡:
溶液中存在平衡: (蓝色)
(蓝色)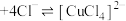 (黄色)
(黄色)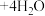
(1)取两支试管,分别加入2 mL 0.5 mol/L
 溶液,溶液呈绿色,其原因为
溶液,溶液呈绿色,其原因为(2)将其中一支试管加热,溶液变为黄绿色,则该反应的

 溶液,静置,上层清液呈
溶液,静置,上层清液呈Ⅱ.电离平衡常数
(3)
 是二元弱酸,其电离平衡常数
是二元弱酸,其电离平衡常数 的表达式为
的表达式为(4)向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L
 溶液,观察到试管中有气泡产生,由此推断的
溶液,观察到试管中有气泡产生,由此推断的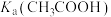
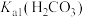 (填“>”或“<”),发生反应的离子方程式为
(填“>”或“<”),发生反应的离子方程式为Ⅲ.盐类水解的应用
(5)向一支试管中加入少量
 晶体,然后加入5 mL蒸馏水、振荡,观察到
晶体,然后加入5 mL蒸馏水、振荡,观察到 慢慢溶解,但有少量浑浊,此溶液的pH
慢慢溶解,但有少量浑浊,此溶液的pH 溶液的正确方法是
溶液的正确方法是(6)向一个烧杯中加入40 mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和
 溶液,继续煮沸制得
溶液,继续煮沸制得 胶体。该反应的化学方程式为
胶体。该反应的化学方程式为 胶体呈
胶体呈Ⅳ.亚铁离子的检验
(7)
 与
与 溶液反应有特征蓝色沉淀产生,这是检验溶液中
溶液反应有特征蓝色沉淀产生,这是检验溶液中 的常用方法。写出该反应的离子方程式:
的常用方法。写出该反应的离子方程式:
您最近一年使用:0次
2024-02-11更新
|
84次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期1月月考化学试题
名校
解题方法
3 .  是一种常用的化学添加剂,广泛应用于塑料、合成橡胶的化工生产中.一种以工业含锌废渣(主要成分为
是一种常用的化学添加剂,广泛应用于塑料、合成橡胶的化工生产中.一种以工业含锌废渣(主要成分为 ,还含有
,还含有 、
、 、
、 及
及 等)制取高纯
等)制取高纯 的工艺流程如图所示:
的工艺流程如图所示:

已知:相关金属离子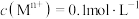 生成氢氧化物沉淀的
生成氢氧化物沉淀的 如下表所示:
如下表所示:
(1)“粉碎”的目的是_______________ .
(2)“酸浸”时通入过量空气的作用是__________________________ (用离子方程式表示).
(3)利用表格中的数据,计算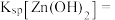
_________________ .
(4)“调 ”的范围是
”的范围是_____________ ,滤渣2经酸溶等进一步处理后可获得 晶体,其中由
晶体,其中由 溶液制取
溶液制取 晶体的操作方法是
晶体的操作方法是_______________________________________ .
(5)在废水处理中常用 将
将 转化
转化 除去,向含有
除去,向含有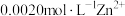 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的
气体,调节溶液的 ,当
,当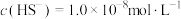 时,
时, 开始沉淀,则
开始沉淀,则
__________ (已知:25℃时, 的电离常数
的电离常数 ,
,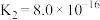 ;
; )
)
 是一种常用的化学添加剂,广泛应用于塑料、合成橡胶的化工生产中.一种以工业含锌废渣(主要成分为
是一种常用的化学添加剂,广泛应用于塑料、合成橡胶的化工生产中.一种以工业含锌废渣(主要成分为 ,还含有
,还含有 、
、 、
、 及
及 等)制取高纯
等)制取高纯 的工艺流程如图所示:
的工艺流程如图所示:
已知:相关金属离子
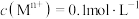 生成氢氧化物沉淀的
生成氢氧化物沉淀的 如下表所示:
如下表所示:
|
|
|
|
| |
开始沉淀 | 6.3 | 1.5 | 3.4 | 6.5 | 7.4 |
沉淀完全 | 8.3 | 2.8 | 4.7 | 8.5 | 9.4 |
(1)“粉碎”的目的是
(2)“酸浸”时通入过量空气的作用是
(3)利用表格中的数据,计算
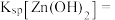
(4)“调
 ”的范围是
”的范围是 晶体,其中由
晶体,其中由 溶液制取
溶液制取 晶体的操作方法是
晶体的操作方法是(5)在废水处理中常用
 将
将 转化
转化 除去,向含有
除去,向含有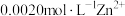 的废水中通入一定量的
的废水中通入一定量的 气体,调节溶液的
气体,调节溶液的 ,当
,当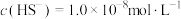 时,
时, 开始沉淀,则
开始沉淀,则
 的电离常数
的电离常数 ,
,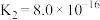 ;
; )
)
您最近一年使用:0次
名校
4 . 实验室利用 和亚硫酰氯(SOCl2)制备无水
和亚硫酰氯(SOCl2)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为
沸点为 ,遇水极易反应生成两种酸性气体。回答下列问题:
,遇水极易反应生成两种酸性气体。回答下列问题:

(1)装置c的名称是___________ ,装置b内发生反应的化学方程式为___________ 。
(2)下列说法正确的是___________。
(3)能由上述装置将下列结晶水合物制备得到相应的无水盐的是___________ (填字母)。
A. B.
B. C.
C.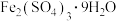
(4)现有含少量杂质的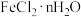 ,为测定n值进行如下实验:
,为测定n值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,用
样品,用足量稀硫酸溶解后,用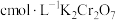 标准溶液滴定
标准溶液滴定 达终点时消耗
达终点时消耗 (滴定过程中
(滴定过程中 转化为Cr3+,Cl-不反应)。
转化为Cr3+,Cl-不反应)。
实验Ⅱ:另取 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为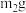 。
。
①上述滴定滴定过程中,下列操作正确的是___________ (填字母)。
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.滴定时,常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.滴定时,眼睛应注视滴定管内液面高度变化
②下列情况会导致n测量值偏小的是___________ (填字母)。
A.若样品中含少量 杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
C.样品与 反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
③若样品中所含的少量杂质不参与反应,则
___________ (用含 、c、V的表达式表示)
、c、V的表达式表示)
 和亚硫酰氯(SOCl2)制备无水
和亚硫酰氯(SOCl2)制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为
沸点为 ,遇水极易反应生成两种酸性气体。回答下列问题:
,遇水极易反应生成两种酸性气体。回答下列问题:
(1)装置c的名称是
(2)下列说法正确的是___________。
A.实验开始先通 一段时间后,应先加热装置a,再加热装置b 一段时间后,应先加热装置a,再加热装置b |
| B.两处洗气瓶e中均可装入浓硫酸 |
C.装置c、d,共同起到的作用冷凝回流 |
| D.装置f既可吸收尾气,又可防止倒吸,烧杯中可加入水 |
(3)能由上述装置将下列结晶水合物制备得到相应的无水盐的是
A.
 B.
B. C.
C.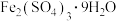
(4)现有含少量杂质的
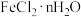 ,为测定n值进行如下实验:
,为测定n值进行如下实验:实验Ⅰ:称取
 样品,用足量稀硫酸溶解后,用
样品,用足量稀硫酸溶解后,用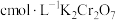 标准溶液滴定
标准溶液滴定 达终点时消耗
达终点时消耗 (滴定过程中
(滴定过程中 转化为Cr3+,Cl-不反应)。
转化为Cr3+,Cl-不反应)。实验Ⅱ:另取
 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为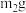 。
。①上述滴定滴定过程中,下列操作正确的是
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.滴定时,常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.滴定时,眼睛应注视滴定管内液面高度变化
②下列情况会导致n测量值偏小的是
A.若样品中含少量
 杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成C.样品与
 反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解③若样品中所含的少量杂质不参与反应,则

 、c、V的表达式表示)
、c、V的表达式表示)
您最近一年使用:0次
2023-12-23更新
|
123次组卷
|
2卷引用:江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷
5 . 磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
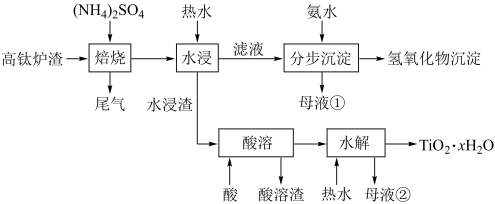
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:___________ 。
(2)pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:___________ 。
(3)根据表中信息,计算Mg(OH)2 的Ksp=___________ 。
(4)“水浸渣”在160℃ “酸溶”最适合的酸是___________ 。“酸溶渣”的成分是___________ 、___________ 。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:___________ 。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得___________ ,循环利用。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
| 沉淀完全(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 11.0 | 13.8 |
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:
(2)pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:
(3)根据表中信息,计算Mg(OH)2 的Ksp=
(4)“水浸渣”在160℃ “酸溶”最适合的酸是
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得
您最近一年使用:0次
2023-12-23更新
|
148次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
6 . 运用化学反应原理分析解答以下问题
(1)已知:①

②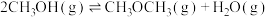
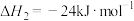
③
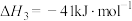
且三个反应的平衡常数依次为 、
、 、
、
则反应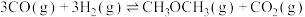

_____ 。化学平衡常数
_____ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)一定条件下,若将体积比为1∶2的CO和 气体通入体积一定的密闭容器中发生反应
气体通入体积一定的密闭容器中发生反应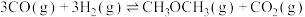 ,下列能说明反应达到平衡状态是
,下列能说明反应达到平衡状态是_____ 。
a.体系压强保持不变
b.混合气体密度保持不变
c.CO和 的物质的量保持不变
的物质的量保持不变
d.CO的消耗速度等于 的生成速率
的生成速率
(3)实验室配制的 溶液,常常出现浑浊,可采取在配制时加入少量
溶液,常常出现浑浊,可采取在配制时加入少量_____ 防止浑浊。
(4)已知某温度时,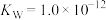 ,
, 溶液的水解常数
溶液的水解常数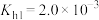 ,则当溶液中
,则当溶液中 时,试求该溶液的pH=
时,试求该溶液的pH=_____ 。
(5)氨气溶于水得到氨水。在25℃下,将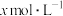 的氨水与
的氨水与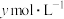 的盐酸等体积混合,反应后溶液显中性,则
的盐酸等体积混合,反应后溶液显中性,则
_____  (填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数_____ 。
(1)已知:①


②
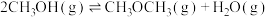
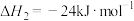
③

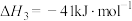
且三个反应的平衡常数依次为
 、
、 、
、
则反应
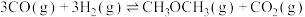


 、
、 、
、 的代数式表示)。
的代数式表示)。(2)一定条件下,若将体积比为1∶2的CO和
 气体通入体积一定的密闭容器中发生反应
气体通入体积一定的密闭容器中发生反应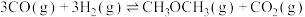 ,下列能说明反应达到平衡状态是
,下列能说明反应达到平衡状态是a.体系压强保持不变
b.混合气体密度保持不变
c.CO和
 的物质的量保持不变
的物质的量保持不变d.CO的消耗速度等于
 的生成速率
的生成速率(3)实验室配制的
 溶液,常常出现浑浊,可采取在配制时加入少量
溶液,常常出现浑浊,可采取在配制时加入少量(4)已知某温度时,
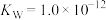 ,
, 溶液的水解常数
溶液的水解常数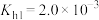 ,则当溶液中
,则当溶液中 时,试求该溶液的pH=
时,试求该溶液的pH=(5)氨气溶于水得到氨水。在25℃下,将
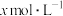 的氨水与
的氨水与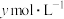 的盐酸等体积混合,反应后溶液显中性,则
的盐酸等体积混合,反应后溶液显中性,则
 (填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数
您最近一年使用:0次
名校
解题方法
7 . 某研究小组为了准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
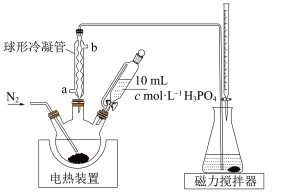
①三颈烧瓶中加入10.00g香菇样品和适量水;锥形瓶中加入适量水、少量淀粉溶液,并预加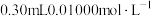 的碘标准溶液,搅拌。
的碘标准溶液,搅拌。
②持续通入 ,再加入过量磷酸并加热,同时用碘标准溶液滴定,至滴定终点时消耗了1.00mL碘标准溶液。
,再加入过量磷酸并加热,同时用碘标准溶液滴定,至滴定终点时消耗了1.00mL碘标准溶液。
③做空白实验,消耗了0.10mL碘标准溶液。
④用适量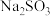 替代香菇样品,重复上述步骤,测得
替代香菇样品,重复上述步骤,测得 的平均回收率为95%。
的平均回收率为95%。
已知25℃时,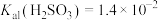 ,
,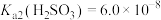
回答下列问题:
(1)球形冷凝管的作用是冷凝回流,冷凝水的进口为___________ (填“a”或“b”)。
(2)持续通入 的目的是
的目的是___________ 、___________ 。
(3)加入 生成
生成 ,滴定时,碘标准溶液与
,滴定时,碘标准溶液与 反应的化学方程式为
反应的化学方程式为___________ ,滴定终点溶液的颜色为___________ 。
(4)步骤②的滴定操作中,会使测得的亚硫酸盐含量偏高的是_______ (填字母)。
A.滴定管水洗后未用标准溶液润洗
B.滴定管尖嘴部分有气泡,滴定后消失
C.滴定终点时俯视并记录数据
(5)常温下 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”),原因是________ 。
(6)该样品中亚硫酸盐含量为___________ 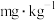 (以
(以 计,结果保留三位有效数字)。
计,结果保留三位有效数字)。

①三颈烧瓶中加入10.00g香菇样品和适量水;锥形瓶中加入适量水、少量淀粉溶液,并预加
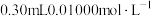 的碘标准溶液,搅拌。
的碘标准溶液,搅拌。②持续通入
 ,再加入过量磷酸并加热,同时用碘标准溶液滴定,至滴定终点时消耗了1.00mL碘标准溶液。
,再加入过量磷酸并加热,同时用碘标准溶液滴定,至滴定终点时消耗了1.00mL碘标准溶液。③做空白实验,消耗了0.10mL碘标准溶液。
④用适量
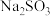 替代香菇样品,重复上述步骤,测得
替代香菇样品,重复上述步骤,测得 的平均回收率为95%。
的平均回收率为95%。已知25℃时,
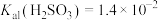 ,
,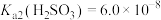
回答下列问题:
(1)球形冷凝管的作用是冷凝回流,冷凝水的进口为
(2)持续通入
 的目的是
的目的是(3)加入
 生成
生成 ,滴定时,碘标准溶液与
,滴定时,碘标准溶液与 反应的化学方程式为
反应的化学方程式为(4)步骤②的滴定操作中,会使测得的亚硫酸盐含量偏高的是
A.滴定管水洗后未用标准溶液润洗
B.滴定管尖嘴部分有气泡,滴定后消失
C.滴定终点时俯视并记录数据
(5)常温下
 溶液呈
溶液呈(6)该样品中亚硫酸盐含量为
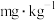 (以
(以 计,结果保留三位有效数字)。
计,结果保留三位有效数字)。
您最近一年使用:0次
2023-11-12更新
|
96次组卷
|
2卷引用:江西省抚州市黎川县第二中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
8 . 为验证SO2的性质并制备NaHSO3和Na2SO3,设计如图所示实验装置(部分夹持装置略去)。
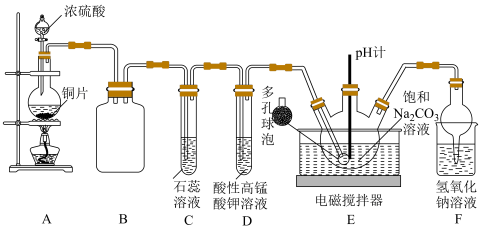
(1)装置A中反应的化学方程式是___________ 。
(2)盛放浓硫酸的仪器名称是___________ ,装置B的作用是___________ 。
(3)试管D中发生反应的离子方程式为___________ 。
(4)装置E中设计多孔球泡的目的是___________ 。
(5)已知:Na2SO3水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如图甲所示,Na2SO3的溶解度曲线如图乙所示。
的物质的量分数随pH的分布如图甲所示,Na2SO3的溶解度曲线如图乙所示。
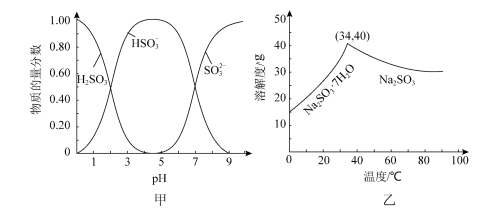
①边搅拌边向装置E中的Na2CO3溶液中通入SO2制备NaHSO3溶液,当pH=___________ 时,停止通入SO2,反应的化学方程式为___________ 。
②由NaHSO3溶液制备Na2SO3的实验方案:边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于___________ ℃条件下趁热过滤。滴加NaOH溶液不能过慢的原因是___________ 。

(1)装置A中反应的化学方程式是
(2)盛放浓硫酸的仪器名称是
(3)试管D中发生反应的离子方程式为
(4)装置E中设计多孔球泡的目的是
(5)已知:Na2SO3水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的分布如图甲所示,Na2SO3的溶解度曲线如图乙所示。
的物质的量分数随pH的分布如图甲所示,Na2SO3的溶解度曲线如图乙所示。
①边搅拌边向装置E中的Na2CO3溶液中通入SO2制备NaHSO3溶液,当pH=
②由NaHSO3溶液制备Na2SO3的实验方案:边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于
您最近一年使用:0次
2023-11-11更新
|
99次组卷
|
3卷引用:江西省上饶市广丰中学2023-2024学年高二上学期12月考试化学试卷
解题方法
9 .  (熔点:
(熔点: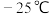 ,沸点:136℃)是制备海绵钛和钛白的主要原料,易水解生成
,沸点:136℃)是制备海绵钛和钛白的主要原料,易水解生成 。某同学利用如图装置制备
。某同学利用如图装置制备 并验证产物CO。
并验证产物CO。

回答下列问题:
(1)仪器X的名称为___________ ,X中所装的试剂是___________ (填名称)。
(2)装置B中收集到的物质是___________ (填化学式),此时该物质为___________ (填状态)。
(3)能证明有CO生成的实验现象是___________ 。
(4)下列装置可以代替装置F的是___________ (填标号)。
a. b.
b.
c. d.
d.
(5)产品中
 含量测定:
含量测定:
取
 产品于烧瓶中,向安全漏斗中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗中液体及烧瓶中混合物全部转入锥形瓶中,滴加几滴指示剂,用
产品于烧瓶中,向安全漏斗中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗中液体及烧瓶中混合物全部转入锥形瓶中,滴加几滴指示剂,用 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液VmL。
溶液VmL。

① 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②安全漏斗中的水在本实验中的作用除液封、作反应物外,还能___________ 。
③该产品的纯度为___________ %。
 (熔点:
(熔点: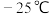 ,沸点:136℃)是制备海绵钛和钛白的主要原料,易水解生成
,沸点:136℃)是制备海绵钛和钛白的主要原料,易水解生成 。某同学利用如图装置制备
。某同学利用如图装置制备 并验证产物CO。
并验证产物CO。
回答下列问题:
(1)仪器X的名称为
(2)装置B中收集到的物质是
(3)能证明有CO生成的实验现象是
(4)下列装置可以代替装置F的是
a.
 b.
b.
c.
 d.
d.
(5)产品中
 含量测定:
含量测定:取

 产品于烧瓶中,向安全漏斗中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗中液体及烧瓶中混合物全部转入锥形瓶中,滴加几滴指示剂,用
产品于烧瓶中,向安全漏斗中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗中液体及烧瓶中混合物全部转入锥形瓶中,滴加几滴指示剂,用 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液VmL。
溶液VmL。
①
 与
与 反应的化学方程式为
反应的化学方程式为②安全漏斗中的水在本实验中的作用除液封、作反应物外,还能
③该产品的纯度为
您最近一年使用:0次
名校
解题方法
10 . 利用转炉烟尘(主要成分:CuO、ZnO、PbO、Sb4O6、As2O5)制备硫酸铜联产硫酸锌以及聚合硫酸铁的工艺流程如图:

已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中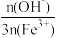 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。
回答下列问题:
(1)“酸浸渣”中所含金属化合物是______ (填化学式)。常温下,调节“酸浸液”pH为______ (保留小数点后一位)时,溶液中c(Cu2+)=0.01mol•L-1。
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为________ 。
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=______ (用含x的式子表示)。
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是________ 。

(4)①“萃余液”经______ 、______ 、过滤、洗涤,得到ZnSO4•7H2O晶体。
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为______ ;温度为1050℃时,ZnSO4固体完全分解为ZnO以及两种气体(只有一种是氧化物),该反应的化学方程式为_______ 。


已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中
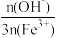 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。回答下列问题:
(1)“酸浸渣”中所含金属化合物是
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是

(4)①“萃余液”经
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为

您最近一年使用:0次



