2023·全国·高考真题
真题
解题方法
1 .  是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
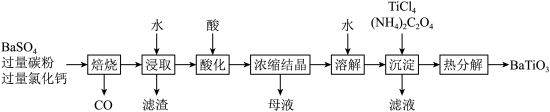
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是_______ 。
(2)“焙烧”后固体产物有 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为_______ 。
(3)“酸化”步骤应选用的酸是_______ (填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?_______ ,其原因是_______ 。
(5)“沉淀”步骤中生成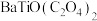 的化学方程式为
的化学方程式为_______ 。
(6)“热分解”生成粉状钛酸钡,产生的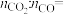
_______ 。
 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是
(2)“焙烧”后固体产物有
 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为(3)“酸化”步骤应选用的酸是
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?
(5)“沉淀”步骤中生成
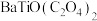 的化学方程式为
的化学方程式为(6)“热分解”生成粉状钛酸钡,产生的
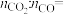
您最近一年使用:0次
2023-06-09更新
|
14017次组卷
|
12卷引用:2023年高考山东卷化学真题变式题(工业流程题)
(已下线)2023年高考山东卷化学真题变式题(工业流程题)2023年高考全国甲卷化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(全国甲卷)(ppt+word)(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
真题
名校
2 . 测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比试验,④产生白色沉淀多。下列说法错误的是( )
| 时刻 | ① | ② | ③ | ④ |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
A.Na2SO3溶液中存在水解平衡:SO +H2O +H2O  HSO HSO +OH- +OH- |
B.④的pH与①不同,是由于SO 浓度减小造成的 浓度减小造成的 |
| C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致 |
| D.①与④的Kw值相等 |
您最近一年使用:0次
2018-06-09更新
|
8584次组卷
|
60卷引用:山东省滨州高新高级中学2022-2023学年高二上学期期中考试化学试题
山东省滨州高新高级中学2022-2023学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(北京卷)辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题(已下线)2018届高三高考题及模拟题汇编 专题10 水溶液中的离子平衡(已下线)2019年高考总复习巅峰冲刺-专题07 电解质溶液应试策略浙江省嘉兴市第一中学2020届高三上学期期中考试化学试题(已下线)专题8.3 盐类水解(讲)-《2020年高考一轮复习讲练测》(已下线)专题8.3 盐类水解(练)-《2020年高考一轮复习讲练测》(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》步步为赢 高二化学寒假作业:综合检测(二)江西省赣州市石城中学2020届高三上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的离子积常数的应用(强化练习)湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题7 盐类水解的基础知识复习题上海市南洋模范中学2019-2020学年高三上学期期中考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题03-2020年北京新高考化学模拟试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训陕西省榆林市绥德县绥德中学2020届高三下学期第五次模拟考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解(已下线)3.3.2+影响盐类水解的主要因素和盐类水解的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)3.2.2+pH的计算及其应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)福建省福州第三中学2019-2020学年高二上学期期末考试化学试题(已下线)【全国百强校】广西桂林市第十八中学2018-2019学年高二下学期期中段考化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关北京清华大学附属中学朝阳分校2020-2021学年高二上学期期中考试化学试题(已下线)第27讲 盐类水解(精讲)——2021年高考化学一轮复习讲练测广东省广州市广大附中、广外2020-2021学年高二上学期期中考试化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)小题必刷32 盐类的水解影响因素及应用——2021年高考化学一轮复习小题必刷(通用版本)上海市七宝中学2021届高三上学期期中考试化学试题浙江省金华市金华十校2020-2021学年高二上学期调研考试化学试题青海省湟川中学2019-2020学年高二上学期期中考试化学试题四川省成都市第七中学2021届高三下学期3月二诊模拟考试理综化学试题(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时42 盐类的水解影响因素及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题(已下线)3.3.2 影响盐类水解的主要因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题河南省郑州市第四高级中学2021-2022学年高二下学期第一次调研考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题河南省顶级名校2022届高三下学期阶段性联考三理科综合化学试题(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第23讲 盐类水解 (练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题八 水溶液中的离子反应与平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)北京市北京师范大学附属中学2022-2023学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题十三水溶液中的离子平衡(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题(已下线)题型136 盐类水解平衡及影响因素(已下线)专题卷12 强弱电解质分析比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)第3课时 盐类水解平衡的移动及其应用北京首都师范大学附属中学2023-2024学年高二上学期10月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期10月月考化学试题四川省射洪中学校2022-2023学年高二下学期3月月考化学试题北京市第十三中学2023-2024学年高二上学期期中考试化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题
名校
3 . Ⅰ.已知 时,电离平衡常数:
时,电离平衡常数:
回答下列问题:
(1)通常情况下,相同浓度的以下四种溶液,碱性最强的是___________。(填序号,下同)
(2)下列反应不能发生的是___________ 。
A.
B.
C.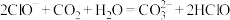
(3)室温下, 通入
通入 溶液中,在所得溶液中,
溶液中,在所得溶液中,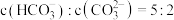 ,溶液的
,溶液的
___________ 。
Ⅱ. 是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。工业上用
是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。工业上用 吸收尾气中
吸收尾气中 使之转化为
使之转化为 ,再以
,再以 为原料设计原电池,然后电解(惰性电极)
为原料设计原电池,然后电解(惰性电极) 制取
制取 ,装置如下:
,装置如下:
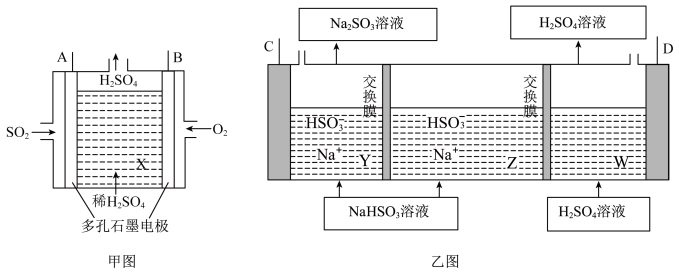
(4)甲图中A电极的电极名称为___________ 极。
(5)甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中 向
向___________ (填“Y”或“W”)中移动。
(6)乙图阳极的电极反应式为___________ 。
 时,电离平衡常数:
时,电离平衡常数:| 化学式 |  |  |  |
| 电离平衡常数 |  | 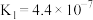  |  |
(1)通常情况下,相同浓度的以下四种溶液,碱性最强的是___________。(填序号,下同)
A. | B. | C. | D. |
A.

B.

C.
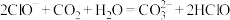
(3)室温下,
 通入
通入 溶液中,在所得溶液中,
溶液中,在所得溶液中,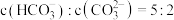 ,溶液的
,溶液的
Ⅱ.
 是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。工业上用
是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。工业上用 吸收尾气中
吸收尾气中 使之转化为
使之转化为 ,再以
,再以 为原料设计原电池,然后电解(惰性电极)
为原料设计原电池,然后电解(惰性电极) 制取
制取 ,装置如下:
,装置如下:
(4)甲图中A电极的电极名称为
(5)甲图中B与乙图
 向
向(6)乙图阳极的电极反应式为
您最近一年使用:0次
2023-09-16更新
|
686次组卷
|
2卷引用:山东省济南市历城第二中学2023-2024学年高二上学期期末化学模拟试题
名校
解题方法
4 . 下列反应中,属于水解反应且使溶液显酸性的是
A. |
B. |
C. |
D. |
您最近一年使用:0次
2021-10-14更新
|
1241次组卷
|
16卷引用:山东省济宁市微山县第二中学2021-2022学年高二12月月考化学试题
山东省济宁市微山县第二中学2021-2022学年高二12月月考化学试题河南省漯河市临颍县南街高级中学2019-2020学年高二下学期期末考试化学试题吉林省四平市实验中学2020-2021学年高二12月月考化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题河北省石家庄市师大附中2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题上海行知中学2021-2022学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期期中考试化学试题河北省邯郸市大名县第一中学2021-2022学年高三上学期11月月考化学试题河南省许昌市2021-2022学年高二上学期期末教学质量检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省黑河市五校(嫩江市第一中学,嫩江市职业高中,黑河七中,伊拉哈中学,海江中学)2021-2022学年高二上学期期末联考化学试题黑龙江省密山市第四中学2021-2022学年高二上学期期中考试化学(理)试题安徽省滁州市定远县育才学校2021-2022学年高二上学期期末考试(普通班)化学试题(已下线)第19讲 盐类的水解-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)黑龙江省哈尔滨市宾县第一中学校2021-2022学年高二上学期第二次月考化学试题
2024·湖北·一模
名校
解题方法
5 . 下列方程式书写错误的是
A.漂白粉在空气中生效: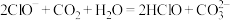 |
B. 水解制取 水解制取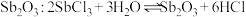 |
C.线型酚醛树脂的制备: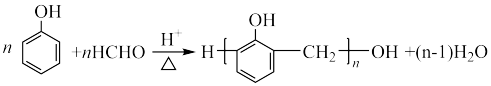 |
D.硅橡胶单体的制备: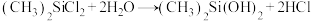 |
您最近一年使用:0次
2024-03-29更新
|
456次组卷
|
4卷引用:山东省名校联盟2024届高三下学期5月模拟考试化学试题
(已下线)山东省名校联盟2024届高三下学期5月模拟考试化学试题湖北省圆创联盟2024届高三三月联合测评(一模)化学试卷湖北省高中名校联盟2023-2024学年高三下学期3月月考化学试题(已下线)选择题6-10
名校
解题方法
6 . 下列有关化学用语的表述正确的是
A.中子数是20的氯原子: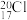 |
B.氢化锂(LiH)中氢离子结构示意图: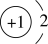 |
C.一氧化碳的结构式: |
D. 水解的离子方程式: 水解的离子方程式: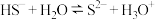 |
您最近一年使用:0次
2022-04-08更新
|
630次组卷
|
4卷引用:山东省青岛市2022高考一模化学试题
名校
7 . 下列过程中的化学反应,相应的离子方程式错误的是
A.氯化铜溶液中通入硫化氢: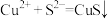 |
B.惰性电极电解氯化镁溶液: |
C.向AgCl悬浊液中滴加 溶液,白色沉淀变成黑色: 溶液,白色沉淀变成黑色: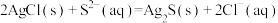 |
D. 水解析出 水解析出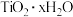 沉淀: 沉淀: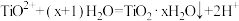 |
您最近一年使用:0次
2022-01-21更新
|
502次组卷
|
4卷引用:山东省日照市2021-2022学年高二上学期期末考试化学试题
8 . 三氯氧磷( )俗名磷酰氯,可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化
)俗名磷酰氯,可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化 制备
制备 。某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去):
。某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去):
部分物质的性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
| -112 | 75.5 | 易水解,遇 |
| 2 | 105.3 | 易水解,能溶于 |

(1)制备
 时进行操作:(ⅰ)连接仪器,检查装置气密性;(ⅱ)……,至C中白磷消失;(ⅲ)……,控制C装置反应温度在60℃~65℃,最终制得
时进行操作:(ⅰ)连接仪器,检查装置气密性;(ⅱ)……,至C中白磷消失;(ⅲ)……,控制C装置反应温度在60℃~65℃,最终制得 产品。操作(ⅱ)为
产品。操作(ⅱ)为(2)已知电负性O>Cl>P,
 在过量NaOH溶液中发生反应的离子方程式为
在过量NaOH溶液中发生反应的离子方程式为(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素的含量,实验步骤如下:
①取m g产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
②向锥形瓶中加入0.1000 的
的 溶液50.00mL,使
溶液50.00mL,使 完全沉淀;
完全沉淀;
③向其中加入2mL硝基苯,用力摇动使沉淀表面被有机物覆盖;
④加入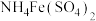 做指示剂用c
做指示剂用c 
 溶液滴定过量
溶液滴定过量 至终点,记下所用体积为V mL。
至终点,记下所用体积为V mL。
标志滴定终点的现象是
您最近一年使用:0次
2023·湖南郴州·三模
名校
解题方法
9 . 下列符号表征错误的是
A. 的水解方程式为: 的水解方程式为: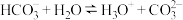 |
B. 分子中σ键的电子云轮廓图: 分子中σ键的电子云轮廓图: |
C. 的VSEPR模型: 的VSEPR模型: |
D. 的形成过程: 的形成过程: |
您最近一年使用:0次
2023-03-24更新
|
341次组卷
|
3卷引用:专题02 化学用语
名校
10 . 探究铝片与Na2CO3溶液的反应。
下列说法错误的是
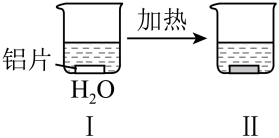 |  | |
| 均无明显现象 | 铝片表面产生细小气泡 | 加热后出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.Na2CO3溶液中存在水解平衡:CO +H2O +H2O HCO HCO +OH- +OH- |
| B.对比I、III说明Na2CO3溶液能破坏铝表面的保护膜 |
C.H2逸出有利于CO 水解平衡向正反应方向移动 水解平衡向正反应方向移动 |
D.推测出现白色浑浊的原因:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
您最近一年使用:0次
2022-05-24更新
|
496次组卷
|
7卷引用:山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题
山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题江苏省常州市常州高级中学2021-2022学年高二下学期期中质量检 化学试题(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用) 四川省成都市石室中学2022-2023学年高二下学期3月月考化学试题(已下线)考点15 铝及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2024届高三上学期月考试卷(一)化学试题江西省丰城中学2023-2024学年高二上学期11月期中考试化学试题

 生成
生成

