1 . 三氯氧磷( )俗名磷酰氯,可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化
)俗名磷酰氯,可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化 制备
制备 。某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去):
。某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去):
部分物质的性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
| -112 | 75.5 | 易水解,遇 |
| 2 | 105.3 | 易水解,能溶于 |

(1)制备
 时进行操作:(ⅰ)连接仪器,检查装置气密性;(ⅱ)……,至C中白磷消失;(ⅲ)……,控制C装置反应温度在60℃~65℃,最终制得
时进行操作:(ⅰ)连接仪器,检查装置气密性;(ⅱ)……,至C中白磷消失;(ⅲ)……,控制C装置反应温度在60℃~65℃,最终制得 产品。操作(ⅱ)为
产品。操作(ⅱ)为(2)已知电负性O>Cl>P,
 在过量NaOH溶液中发生反应的离子方程式为
在过量NaOH溶液中发生反应的离子方程式为(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素的含量,实验步骤如下:
①取m g产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
②向锥形瓶中加入0.1000 的
的 溶液50.00mL,使
溶液50.00mL,使 完全沉淀;
完全沉淀;
③向其中加入2mL硝基苯,用力摇动使沉淀表面被有机物覆盖;
④加入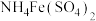 做指示剂用c
做指示剂用c 
 溶液滴定过量
溶液滴定过量 至终点,记下所用体积为V mL。
至终点,记下所用体积为V mL。
标志滴定终点的现象是
您最近半年使用:0次
名校
2 . 磷酸铁锂( )被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:

已知: 是种难溶于水的物质。
是种难溶于水的物质。
(1)基态 原子的单电子数目为
原子的单电子数目为___________ 。
(2)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是___________ 。
(3) 水解生成
水解生成 的离子方程式为
的离子方程式为___________ 。
(4)加入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取 标准液滴定
标准液滴定 的方法:(不考虑
的方法:(不考虑 与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果
与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果___________ (填“偏高”、“偏低”或“无影响”),滴定终点的现象是___________ 。滴定分析时,称取ag钛铁矿,处理后,用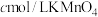 标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
标准液滴定,消耗VmL,则铁元素的质量分数的表达式为___________ 。
 )被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
已知:
 是种难溶于水的物质。
是种难溶于水的物质。(1)基态
 原子的单电子数目为
原子的单电子数目为(2)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是
(3)
 水解生成
水解生成 的离子方程式为
的离子方程式为(4)加入
 发生反应的离子方程式为
发生反应的离子方程式为(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取
 标准液滴定
标准液滴定 的方法:(不考虑
的方法:(不考虑 与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果
与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果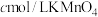 标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
您最近半年使用:0次
名校
解题方法
3 . I.现有常温下的3份溶液:
①0.01mol•L-1CH3COOH溶液;②0.01mol•L-1HCl溶液;③pH=12的氨水
(1)3份溶液中,水的电离程度最大的是______ (填序号)。
(2)若②③混合后所得溶液的pH=7,则消耗溶液的体积:②______ ③(填“>”“<”或“=”)。
(3)等体积的①②溶液分别与足量锌粒反应,生成氢气的体积:①______ ②(填“>”“<”或“=”)。
II.NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(4)能说明Na2HPO4溶液显弱碱性的离子方程式为______ 。
(5)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:样品1.3000g H3PO4
H3PO4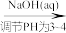 NaH2PO4→配成100.00mL溶液取25.00mL溶液
NaH2PO4→配成100.00mL溶液取25.00mL溶液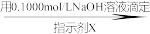 Na2HPO4
Na2HPO4
①滴定时所用的指示剂X可为______ 。
②滴定实验所得数据记录如表(样品中杂质不与酸或碱反应)。
试计算样品中Na5P3O10(Mr=368)的质量分数(结果保留到小数点后一位)______ %。
①0.01mol•L-1CH3COOH溶液;②0.01mol•L-1HCl溶液;③pH=12的氨水
(1)3份溶液中,水的电离程度最大的是
(2)若②③混合后所得溶液的pH=7,则消耗溶液的体积:②
(3)等体积的①②溶液分别与足量锌粒反应,生成氢气的体积:①
II.NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(4)能说明Na2HPO4溶液显弱碱性的离子方程式为
(5)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:样品1.3000g
 H3PO4
H3PO4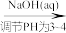 NaH2PO4→配成100.00mL溶液取25.00mL溶液
NaH2PO4→配成100.00mL溶液取25.00mL溶液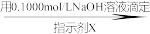 Na2HPO4
Na2HPO4①滴定时所用的指示剂X可为
②滴定实验所得数据记录如表(样品中杂质不与酸或碱反应)。
| 滴定次数 | 待测溶液的体积(mL) | 0.1mol•L-1NaOH溶液的体积 | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
您最近半年使用:0次
名校
解题方法
4 . 绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:___________ ;
(2)过程②对应的化学方程式是:___________ 。
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2 +I2=
+I2= +2I-)
+2I-)
iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是_________ ;
(4)醋酸铜产品中铜元素的质量分数是_______ 。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:
(2)过程②对应的化学方程式是:
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2
 +I2=
+I2= +2I-)
+2I-)iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是
(4)醋酸铜产品中铜元素的质量分数是
您最近半年使用:0次
名校
解题方法
5 . 以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)30.00mL 5.00 mol·L−1的稀硫酸至少能溶解原料的质量为___________ 。
(2)加氨水调节pH促进Fe3+水解,Fe3+水解离子方程式为___________ 。
(3)已知:Ksp[Fe(OH)3]=1.0×10−39,Ksp[Mg(OH)2]=1.0×10−12。室温下,若溶液中c(Mg2+)=0.01mol·L−1,欲使溶液中的c(Fe3+)≤1×10−6mol·L−1,需调节溶液pH范围为___________ 。
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2−)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L−1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L−1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程)。___________
(1)30.00mL 5.00 mol·L−1的稀硫酸至少能溶解原料的质量为
(2)加氨水调节pH促进Fe3+水解,Fe3+水解离子方程式为
(3)已知:Ksp[Fe(OH)3]=1.0×10−39,Ksp[Mg(OH)2]=1.0×10−12。室温下,若溶液中c(Mg2+)=0.01mol·L−1,欲使溶液中的c(Fe3+)≤1×10−6mol·L−1,需调节溶液pH范围为
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2−)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L−1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L−1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程)。
您最近半年使用:0次
2018-12-16更新
|
186次组卷
|
2卷引用:【市级联考】江苏省南京市六校联合体2019届高三上学期12月联考化学试题
6 . 摩尔盐易[(NH4)2Fe(SO4)2]易溶于水,具有还原性。以下是利用废铁屑、稀硫酸和硫酸铵为原料制取摩尔盐的流程图。

回答下列问题:
(1)在“步骤l”中加Na2CO3溶液是为了洗涤除去废铁屑表面的油污,加热的目的是______ (利用简要文字和必要的离子方程式说明),配制100g10%的Na2CO3溶液需要的仪器有药匙、量筒、烧杯、玻璃棒和_______ ;
(2)“步骤2”中所用废铁屑必须过量,原因是______________ ;
(3)“步骤3”加入(NH4)2SO4固体充分搅拌溶解后,依次进行的实验操作是:蒸发浓缩、______ 、过滤、洗涤、干燥;
(4)一般采用滴定法测定摩尔盐产品中Fe2+的含量:称取4.0g摩尔盐样品,溶于水,加入适量稀硫酸,用0.2 mol/LKMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
① 滴定过程中发生反应的离子方程式为___________ ;
② 产品中Fe2+的质量分数为_________ ;
③ 滴定过程中.左手控制________ ,右手摇动锥形瓶,直到_________ 时停止滴定,读数。此时若俯视读数.测定结果将偏________ (填“高”或“低”)。

回答下列问题:
(1)在“步骤l”中加Na2CO3溶液是为了洗涤除去废铁屑表面的油污,加热的目的是
(2)“步骤2”中所用废铁屑必须过量,原因是
(3)“步骤3”加入(NH4)2SO4固体充分搅拌溶解后,依次进行的实验操作是:蒸发浓缩、
(4)一般采用滴定法测定摩尔盐产品中Fe2+的含量:称取4.0g摩尔盐样品,溶于水,加入适量稀硫酸,用0.2 mol/LKMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
① 滴定过程中发生反应的离子方程式为
② 产品中Fe2+的质量分数为
③ 滴定过程中.左手控制
您最近半年使用:0次
2017-03-27更新
|
683次组卷
|
2卷引用:2017届山东省济南市高三第一次模拟考试理科综合化学试卷
7 . 实验小组对硫代硫酸钠(Na2S2O3)进行探究。
I.硫代硫酸钠的制备。
实验室将SO2通入Na2S和Na2CO3混合溶液中可制得Na2S2O3,装置如图:

(1)用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:S2-+H2O HS-+OH-、
HS-+OH-、_______ 。
(2)为保证Na2S2O3的产量,实验中通入的SO2不能过量,则理论上Na2S和SO2的最佳物质的量之比应为_______ 。
Ⅱ.测定样品纯度。
步骤①:准确称取10.00g产品,溶于蒸馏水配成250.00mL溶液。
步骤②:取25.00mL上述溶液注入锥形瓶,加入2~3滴淀粉溶液,用0.05mol•L-1标准碘溶液滴定。已知:2S2O +
+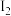 =S4O
=S4O (无色)+2I-,回答下列问题:
(无色)+2I-,回答下列问题:
(3)步骤②中滴定终点的现象为_______ 。
(4)实验数据如表,产品中Na2S2O3的质量分数为_______ (精确到0.1%)。
(5)下列操作会使样品纯度偏小的是_______ 。
A.读数时,滴定前仰视,滴定后俯视
B.滴定过程中,锥形瓶振荡过于剧烈,有少量溶液溅出
C.滴定管用蒸馏水洗净后,未用标准碘溶液润洗
I.硫代硫酸钠的制备。
实验室将SO2通入Na2S和Na2CO3混合溶液中可制得Na2S2O3,装置如图:

(1)用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:S2-+H2O
 HS-+OH-、
HS-+OH-、(2)为保证Na2S2O3的产量,实验中通入的SO2不能过量,则理论上Na2S和SO2的最佳物质的量之比应为
Ⅱ.测定样品纯度。
步骤①:准确称取10.00g产品,溶于蒸馏水配成250.00mL溶液。
步骤②:取25.00mL上述溶液注入锥形瓶,加入2~3滴淀粉溶液,用0.05mol•L-1标准碘溶液滴定。已知:2S2O
 +
+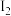 =S4O
=S4O (无色)+2I-,回答下列问题:
(无色)+2I-,回答下列问题:(3)步骤②中滴定终点的现象为
(4)实验数据如表,产品中Na2S2O3的质量分数为
| 滴定次数 | 滴定前/mL | 滴定后/mL |
| 第一次 | 0.10 | 19.90 |
| 第二次 | 0.25 | 20.25 |
| 第三次 | 0.00 | 20.20 |
(5)下列操作会使样品纯度偏小的是
A.读数时,滴定前仰视,滴定后俯视
B.滴定过程中,锥形瓶振荡过于剧烈,有少量溶液溅出
C.滴定管用蒸馏水洗净后,未用标准碘溶液润洗
您最近半年使用:0次
8 . 钛白粉(主要成分 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:

已知:“酸溶”后钛主要以 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成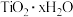
(1) 中
中 的化合价为
的化合价为___________ 。
(2)“酸溶”时主要成分发生反应的离子方程式为___________ ;废渣的主要成分为___________ 。
(3)“还原”时试剂X应选择合适的试剂是___________ ;常温下溶解度:
__________ 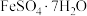 (填“大于”或“小于”)。
(填“大于”或“小于”)。
(4)“氧化”时发生的主要反应化学方程式为___________ 。
(5)以上两种工艺流程中,循环使用的物质有___________ ;请说出方法一优于方法二的理由___________ (写出一条即可)。
(6)若钛铁矿中 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为___________ %(用含m的计算式表示)。
 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
已知:“酸溶”后钛主要以
 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成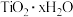
(1)
 中
中 的化合价为
的化合价为(2)“酸溶”时主要成分发生反应的离子方程式为
(3)“还原”时试剂X应选择合适的试剂是

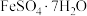 (填“大于”或“小于”)。
(填“大于”或“小于”)。(4)“氧化”时发生的主要反应化学方程式为
(5)以上两种工艺流程中,循环使用的物质有
(6)若钛铁矿中
 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为
您最近半年使用:0次
名校
解题方法
9 . 三草酸合铁酸钾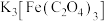 是制作蓝图的感光剂,光照下转化为黄色的
是制作蓝图的感光剂,光照下转化为黄色的 。已知:
。已知: 在水中的溶解度:
在水中的溶解度: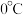 时,
时,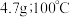 时,
时,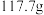
(1)制备 晶体
晶体
I.向 溶液中加入
溶液中加入 溶液,得到黄色沉淀
溶液,得到黄色沉淀 ;
;
Ⅱ.过滤,在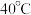 条件下向沉淀中加入
条件下向沉淀中加入 和
和 溶液,沉淀变为红褐色;
溶液,沉淀变为红褐色;
Ⅲ.待沉淀转化完全后,将浊液煮沸 ;停止加热,加入
;停止加热,加入 溶液,红褐色沉淀溶解,得到
溶液,红褐色沉淀溶解,得到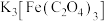 溶液;
溶液;
Ⅳ.___________(操作),得到 晶体。
晶体。
①配制 溶液需要加入稀硫酸,目的是防止氧化和
溶液需要加入稀硫酸,目的是防止氧化和___________ (用化学用语表示)。
②配平Ⅱ中反应方程式:___________ 。

③取少量Ⅱ中产物,先加入足量硫酸,___________ (填操作和现象),说明 完全反应。
完全反应。
④Ⅲ中将浊液煮沸 的目的是
的目的是___________ 。
⑤Ⅱ中加入 与
与 的物质的量比值大于2(理论值),结合化学方程式解释原因:
的物质的量比值大于2(理论值),结合化学方程式解释原因:___________ 。
⑥Ⅳ中的操作是___________ 。
(2)产品纯度检测
i.称量 制得的
制得的 样品,加水溶解,并加入稀
样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;
ii.加入过量 粉,反应完全后,弃去不溶物,向溶液中加入稀
粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用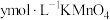 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知:ⅱ中 粉将铁元素全部还原为
粉将铁元素全部还原为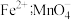 转化为
转化为 。
。
①步骤ⅰ的目的是___________ 。
②该样品中铁元素的质量分数是___________ (用含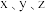 的代数式表示)。
的代数式表示)。
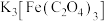 是制作蓝图的感光剂,光照下转化为黄色的
是制作蓝图的感光剂,光照下转化为黄色的 。已知:
。已知: 在水中的溶解度:
在水中的溶解度: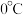 时,
时,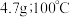 时,
时,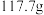
(1)制备
 晶体
晶体I.向
 溶液中加入
溶液中加入 溶液,得到黄色沉淀
溶液,得到黄色沉淀 ;
;Ⅱ.过滤,在
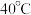 条件下向沉淀中加入
条件下向沉淀中加入 和
和 溶液,沉淀变为红褐色;
溶液,沉淀变为红褐色;Ⅲ.待沉淀转化完全后,将浊液煮沸
 ;停止加热,加入
;停止加热,加入 溶液,红褐色沉淀溶解,得到
溶液,红褐色沉淀溶解,得到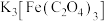 溶液;
溶液;Ⅳ.___________(操作),得到
 晶体。
晶体。①配制
 溶液需要加入稀硫酸,目的是防止氧化和
溶液需要加入稀硫酸,目的是防止氧化和②配平Ⅱ中反应方程式:

③取少量Ⅱ中产物,先加入足量硫酸,
 完全反应。
完全反应。④Ⅲ中将浊液煮沸
 的目的是
的目的是⑤Ⅱ中加入
 与
与 的物质的量比值大于2(理论值),结合化学方程式解释原因:
的物质的量比值大于2(理论值),结合化学方程式解释原因:⑥Ⅳ中的操作是
(2)产品纯度检测
i.称量
 制得的
制得的 样品,加水溶解,并加入稀
样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;ii.加入过量
 粉,反应完全后,弃去不溶物,向溶液中加入稀
粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用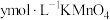 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:ⅱ中
 粉将铁元素全部还原为
粉将铁元素全部还原为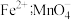 转化为
转化为 。
。①步骤ⅰ的目的是
②该样品中铁元素的质量分数是
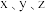 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
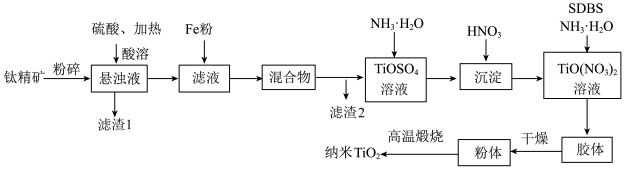
10 . 纳米 具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁
具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁 ,含少量
,含少量 等杂质]制备纳米
等杂质]制备纳米 的工艺流程,整个过程中钛的化合价没有变化。
的工艺流程,整个过程中钛的化合价没有变化。
已知:① 易溶于水,溶液无色透明;
易溶于水,溶液无色透明;
②SDBS(十二烷基苯磺酸钠)是表面活性剂,它能包覆在晶粒表面形成胶体,防止形成较大颗粒。
(1)滤液中钛以 的形式存在,则酸溶时
的形式存在,则酸溶时 与硫酸发生反应的化学方程式为
与硫酸发生反应的化学方程式为________________ ;向滤液中加入Fe粉的作用是________________ 。
(2)向 溶液中加入
溶液中加入 调节溶液的pH,当pH大于2时
调节溶液的pH,当pH大于2时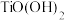 沉淀完全,该反应的离子方程式为
沉淀完全,该反应的离子方程式为________________ ;验证沉淀充分洗涤干净的方法为________________ 。
(3)如图为不同条件下形成的二氧化钛晶粒的尺寸与外界条件的变化关系图。

为了获得15nm-20nm左右的二氧化钛晶体,选用SDBS质量分数为________ ,选用pH范围为________ 。
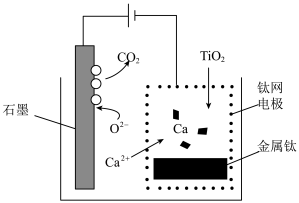
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融的 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为
作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为________________ 。
 具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁
具有优良的光催化活性,可用于太阳能电池和污水净化等。如图示意用钛精矿[主要成分是钛酸亚铁 ,含少量
,含少量 等杂质]制备纳米
等杂质]制备纳米 的工艺流程,整个过程中钛的化合价没有变化。
的工艺流程,整个过程中钛的化合价没有变化。
已知:①
 易溶于水,溶液无色透明;
易溶于水,溶液无色透明;②SDBS(十二烷基苯磺酸钠)是表面活性剂,它能包覆在晶粒表面形成胶体,防止形成较大颗粒。
(1)滤液中钛以
 的形式存在,则酸溶时
的形式存在,则酸溶时 与硫酸发生反应的化学方程式为
与硫酸发生反应的化学方程式为(2)向
 溶液中加入
溶液中加入 调节溶液的pH,当pH大于2时
调节溶液的pH,当pH大于2时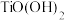 沉淀完全,该反应的离子方程式为
沉淀完全,该反应的离子方程式为(3)如图为不同条件下形成的二氧化钛晶粒的尺寸与外界条件的变化关系图。

为了获得15nm-20nm左右的二氧化钛晶体,选用SDBS质量分数为
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融的
 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为
作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛,装置如图所示。电解时阴极发生的电极反应为
您最近半年使用:0次

 生成
生成

