名校
解题方法
1 . 水溶液广泛存在于生命体及其赖以生存的环境中,研究水溶液的性质及反应有重要意义。室温下,相关酸的电离平衡常数如下表所示:
回答下列问题。
(1) 的电离方程式是
的电离方程式是________________________ 。
(2)pH相同的 溶液和
溶液和 溶液,溶液的浓度
溶液,溶液的浓度
______  (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
(3)室温下,用标准NaOH溶液滴定未知浓度的 溶液。
溶液。
①溶液中的
______ (填“增大”“减小”“不变”或“无法判断”)。
② 溶液显
溶液显______ (填“酸性”、“碱性”或“中性”),用离子方程式表示其原因:____________ 。
③当滴加NaOH溶液至溶液中的 ,此时溶液中的pH
,此时溶液中的pH______ 7(填“<”“=”或“>”),判断的依据__________________ 。
(4)84消毒液在生活中有广泛的应用,其主要成份是NaCl和NaClO。
资料:HClO的氧化性和杀菌消毒效果强于 。
。
①待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为__________________ ,请结合电离平衡常数解释消毒效果增强的原因____________ 。
②为了防止消毒液在存储过程中失效,通常要在制备过程中使NaOH过量,请用平衡移动原理解释NaOH的作用__________________ 。
| 酸 |  |  | HClO |  |
电离平衡常数 |  |  |  |   |
(1)
 的电离方程式是
的电离方程式是(2)pH相同的
 溶液和
溶液和 溶液,溶液的浓度
溶液,溶液的浓度
 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。(3)室温下,用标准NaOH溶液滴定未知浓度的
 溶液。
溶液。①溶液中的

②
 溶液显
溶液显③当滴加NaOH溶液至溶液中的
 ,此时溶液中的pH
,此时溶液中的pH(4)84消毒液在生活中有广泛的应用,其主要成份是NaCl和NaClO。
资料:HClO的氧化性和杀菌消毒效果强于
 。
。①待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为
②为了防止消毒液在存储过程中失效,通常要在制备过程中使NaOH过量,请用平衡移动原理解释NaOH的作用
您最近一年使用:0次
2 . 草酸是植物(特别是草本植物)常具有的成分,有广泛的用途。草酸晶体( )无色,熔点为101℃,易溶于水。常温下草酸的电离常数
)无色,熔点为101℃,易溶于水。常温下草酸的电离常数 ,
, 。
。
(1)写出草酸第一步电离方程式:______
(2)草酸具有很强的还原性,与氧化剂作用易被氧化成二氧化碳和水,可以使酸性高锰酸钾( )溶液褪色,写出发生反应的离子方程式:
)溶液褪色,写出发生反应的离子方程式:______ 。为了探究浓度对化学反应速率的影响,相同温度条件下,分别用2支试管设计了如下实验:
此实验中,加入 溶液的体积应为
溶液的体积应为______ mL。
(3)结合题干所给的电离平衡常数,判断 溶液的酸碱性,应显
溶液的酸碱性,应显______ 性(填“酸”或“碱”)。
(4)设计实验证明草酸为弱酸的方案及其现象均正确的有______(填序号)。
(5)为测定某 溶液的浓度,取20.00mL
溶液的浓度,取20.00mL 溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
①若所用指示剂为酚酞,则滴定终点时的现象为______ ;
② 溶液物质的量浓度为
溶液物质的量浓度为______ mol/L;
③下列操作会引起测定结果偏高的是______ (填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.锥形瓶水洗后未干燥
D.滴定前读数正确,滴定终点时仰视读数
 )无色,熔点为101℃,易溶于水。常温下草酸的电离常数
)无色,熔点为101℃,易溶于水。常温下草酸的电离常数 ,
, 。
。(1)写出草酸第一步电离方程式:
(2)草酸具有很强的还原性,与氧化剂作用易被氧化成二氧化碳和水,可以使酸性高锰酸钾(
 )溶液褪色,写出发生反应的离子方程式:
)溶液褪色,写出发生反应的离子方程式:试管 | A | B |
加入试剂 | 4mL 0.01moL/L | ______0.02moL/L |
1mL 0.1moL/L | 1mL 0.1moL/L | |
2mL 0.1moL/L | 2mL 0.1moL/L |
 溶液的体积应为
溶液的体积应为(3)结合题干所给的电离平衡常数,判断
 溶液的酸碱性,应显
溶液的酸碱性,应显(4)设计实验证明草酸为弱酸的方案及其现象均正确的有______(填序号)。
A.室温下,取0.01mol/L 溶液,测其pH=2; 溶液,测其pH=2; |
B.室温下,取0.01mol/L 溶液,测其pH>7; 溶液,测其pH>7; |
C.室温下,取pH=a( )的 )的 溶液稀释100倍后,测其 溶液稀释100倍后,测其 ; ; |
D.标况下,取0.1moL/L的 溶液100mL与足量锌粉反应,收集到 溶液100mL与足量锌粉反应,收集到 体积为224mL; 体积为224mL; |
 溶液的浓度,取20.00mL
溶液的浓度,取20.00mL 溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。①若所用指示剂为酚酞,则滴定终点时的现象为
②
 溶液物质的量浓度为
溶液物质的量浓度为③下列操作会引起测定结果偏高的是
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.锥形瓶水洗后未干燥
D.滴定前读数正确,滴定终点时仰视读数
您最近一年使用:0次
3 . 填空。
I.
(1)配制200 mL 0.2 mol/L Na2SO3溶液,下列哪些玻璃仪器会用到_______ 。
(2)用离子方程式解释Na2SO3溶液呈碱性的原因:_______ 。
II.化学小组用双液原电池原理研究酸碱性对物质氧化性、还原性强弱的影响。通过改变溶液酸碱性,观察电压表读数的变化,读数越大,则对应物质的氧化性(或还原性)越强。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
② 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 Mn2+;在中性和弱碱性溶液中,被还原为 MnO2;在强碱性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 Mn2+;在中性和弱碱性溶液中,被还原为 MnO2;在强碱性溶液中,被还原为 。
。

(3)连接电压表,形成闭合回路,电极 B 应和图中电压表的_______ 极(填“a”或“b”)柱相连,测得初始电压为 V1。
(4)实验装置要置于水浴内的原因:_______ 。
实验操作和读数记录如下:
(5)同学甲根据实验③推导出酸性增强,KMnO4 的氧化性增强,实验②可以得出:_______ 。
(6)同学乙认为实验①中,加入酸后,还原剂转化成了_______ (填化学式)。
(7)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入_______ ,测得电压为V2,以此作为实验①②的初始电压。
(8)同学丁认为,实验④加入5 mL NaOH溶液后,右边烧杯内的电极反应为:_______ 。
I.
(1)配制200 mL 0.2 mol/L Na2SO3溶液,下列哪些玻璃仪器会用到

(2)用离子方程式解释Na2SO3溶液呈碱性的原因:
II.化学小组用双液原电池原理研究酸碱性对物质氧化性、还原性强弱的影响。通过改变溶液酸碱性,观察电压表读数的变化,读数越大,则对应物质的氧化性(或还原性)越强。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
②
 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 Mn2+;在中性和弱碱性溶液中,被还原为 MnO2;在强碱性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 Mn2+;在中性和弱碱性溶液中,被还原为 MnO2;在强碱性溶液中,被还原为 。
。
(3)连接电压表,形成闭合回路,电极 B 应和图中电压表的
(4)实验装置要置于水浴内的原因:
实验操作和读数记录如下:
| 左烧杯(Na2SO4/Na2SO3) | 右烧杯(KMnO4,调 pH=4) | 电压表读数变化 | |
| ① | ①逐滴加入5 mL 0.05 mol/L H2SO4 | 由V1逐渐降低 | |
| ② | ② 逐滴加入5 mL 0.1 mol/L NaOH | 由V1逐渐升高 | |
| ③ | 逐滴加入5 mL 0.05 mol/L H2SO4 | 由V1逐渐升高 | |
| ④ | 加入少量 0.1 mol/L NaOH | 由V1略微下降 | |
| ① | 继续逐滴加入NaOH至5 mL | 再迅速下降 |
(6)同学乙认为实验①中,加入酸后,还原剂转化成了
(7)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入
(8)同学丁认为,实验④加入5 mL NaOH溶液后,右边烧杯内的电极反应为:
您最近一年使用:0次
2023-01-11更新
|
345次组卷
|
2卷引用:广东省汕尾市2023届高三学生调研考试化学试题
名校
4 . 某实验小组欲探究醛的银镜反应用银氨溶液而不直接用 溶液的原因。
溶液的原因。
(一)甲同学进行了如下对比实验:
(1)请写出配制银氨溶液过程中发生化学反应的离子方程式:_______ 。
(2)乙同学查阅资料,发现醛的银镜反应机理分为如下三步:
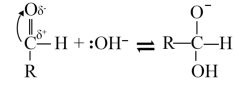 ①
①
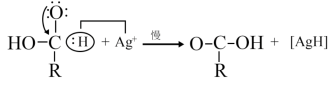 ②
②
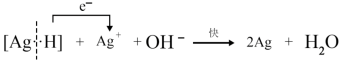 ③
③
据此,乙设计了更好的银镜实验Ⅲ:2% 溶液1 mL,加入3滴1 mol/L NaOH溶液,再加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热,很快出现了银镜。根据实验Ⅰ、Ⅱ、Ⅲ并结合反应机理,得出的结论是
溶液1 mL,加入3滴1 mol/L NaOH溶液,再加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热,很快出现了银镜。根据实验Ⅰ、Ⅱ、Ⅲ并结合反应机理,得出的结论是_______ 。
(3)丙同学为了确认 溶液能氧化醛,继续查找资料,找到了不同浓度的
溶液能氧化醛,继续查找资料,找到了不同浓度的 溶液对室内HCHO气体去除效果如图。
溶液对室内HCHO气体去除效果如图。
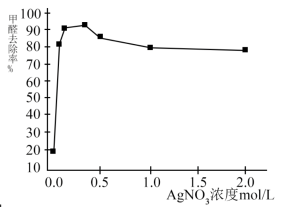
从图中可见: 溶液浓度达到一定程度,HCHO的去除率基本不变,原因是
溶液浓度达到一定程度,HCHO的去除率基本不变,原因是 溶液浓度越高,酸性越强,降低了HCHO的还原性;用化学方程式表示AgNO3溶液显酸性的原因:
溶液浓度越高,酸性越强,降低了HCHO的还原性;用化学方程式表示AgNO3溶液显酸性的原因:_______ 。同时,说明了 溶液和HCHO反应的氧化剂不是
溶液和HCHO反应的氧化剂不是_______ 。
(4)结合甲乙丙的实验和资料,丁同学进一步提出,溶液的pH稳定,有利于快速形成均匀光亮的银镜。在乙醛与银氨溶液反应体系中,存在由_______ 组成的缓冲溶液,可以维持溶液pH稳定。
 溶液的原因。
溶液的原因。(一)甲同学进行了如下对比实验:
| 实验装置 | 序号 | 实验操作 | 实验现象 |
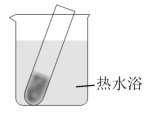 | Ⅰ | 2% 溶液1mL,加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 溶液1mL,加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 试管内壁出现光亮的银镜 |
| Ⅱ | 2% 溶液1mL,加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 溶液1mL,加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 无明显现象 |
(2)乙同学查阅资料,发现醛的银镜反应机理分为如下三步:
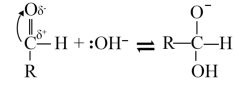 ①
① ②
②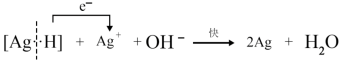 ③
③据此,乙设计了更好的银镜实验Ⅲ:2%
 溶液1 mL,加入3滴1 mol/L NaOH溶液,再加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热,很快出现了银镜。根据实验Ⅰ、Ⅱ、Ⅲ并结合反应机理,得出的结论是
溶液1 mL,加入3滴1 mol/L NaOH溶液,再加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热,很快出现了银镜。根据实验Ⅰ、Ⅱ、Ⅲ并结合反应机理,得出的结论是(3)丙同学为了确认
 溶液能氧化醛,继续查找资料,找到了不同浓度的
溶液能氧化醛,继续查找资料,找到了不同浓度的 溶液对室内HCHO气体去除效果如图。
溶液对室内HCHO气体去除效果如图。
从图中可见:
 溶液浓度达到一定程度,HCHO的去除率基本不变,原因是
溶液浓度达到一定程度,HCHO的去除率基本不变,原因是 溶液浓度越高,酸性越强,降低了HCHO的还原性;用化学方程式表示AgNO3溶液显酸性的原因:
溶液浓度越高,酸性越强,降低了HCHO的还原性;用化学方程式表示AgNO3溶液显酸性的原因: 溶液和HCHO反应的氧化剂不是
溶液和HCHO反应的氧化剂不是(4)结合甲乙丙的实验和资料,丁同学进一步提出,溶液的pH稳定,有利于快速形成均匀光亮的银镜。在乙醛与银氨溶液反应体系中,存在由
您最近一年使用:0次
名校
5 . 砷(As)与氮(N)是同主族元素,它们的化合物在生活、生产和科学研究中有重要的作用。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为___________ (用离子方程式表示)。常温下,HNO2电离常数Ka(HNO2)约为___________ 。
(2)查阅资料知:5 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为___________ 。通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是___________ (填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是___________ (填化学式)。欲用1L NaNO2溶液将0.01mol AgCl完全转化为AgNO2,则NaNO2溶液的浓度需要满足___________ 。
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
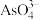 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
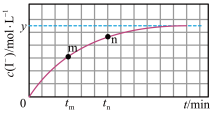
①m点时υ逆___________ n点时υ正(填“>”、“=”或“<”)。
②若平衡时溶液的pH=13,该反应的平衡常数K=___________ (用含y的代数式表示)。
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)___________ c( )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中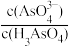 =
=___________ 。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为
(2)查阅资料知:5
 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
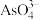 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
①m点时υ逆
②若平衡时溶液的pH=13,该反应的平衡常数K=
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)
 )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中
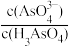 =
=
您最近一年使用:0次
真题
6 . 硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式________________________ 。
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________ 、______________________ 。
(3)室温下,0.1mol/L的硫化钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是_______ ,其原因是________ 。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________ 。
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____ 、______ 。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________ 。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。
(3)室温下,0.1mol/L的硫化钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有
您最近一年使用:0次
7 . 将过量的 溶液滴入到一定量
溶液滴入到一定量 溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
(一)猜想与假设
猜想一:固体为 。
。
猜想二:固体为 ,理由:
,理由: 溶液呈
溶液呈_______ (填“酸性”或“碱性”)。
猜想三:固体为 和
和 的混合物。
的混合物。
(二)查阅资料
① 和
和 晶体均不带结晶水;
晶体均不带结晶水;
② 、
、 受热易分解分别生成两种氧化物。
受热易分解分别生成两种氧化物。
(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经_______ 、洗涤、低温烘干得蓝色固体。
Ⅱ.用如图所示装置,探究固体的成分。
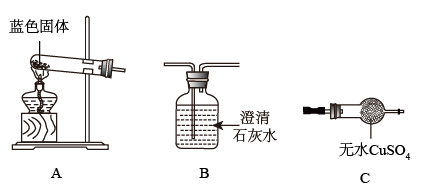
(1)若用装置A、B组合进行实验,B中无现象,则猜想_______ 正确。
(2)若用装置A、C组合进行实验,C中无现象,则猜想_______ 正确。
(3)小组同学将装置按A、_______ 、_______ (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的。实验中:B中的现象为_______ ,C中的现象为_______ 。
(四)实验结论:固体为 和
和 的混合物。
的混合物。
经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的 溶液和一定量
溶液和一定量 反应的离子方程式
反应的离子方程式_______ 。
 溶液滴入到一定量
溶液滴入到一定量 溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。(一)猜想与假设
猜想一:固体为
 。
。猜想二:固体为
 ,理由:
,理由: 溶液呈
溶液呈猜想三:固体为
 和
和 的混合物。
的混合物。(二)查阅资料
①
 和
和 晶体均不带结晶水;
晶体均不带结晶水;②
 、
、 受热易分解分别生成两种氧化物。
受热易分解分别生成两种氧化物。(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经
Ⅱ.用如图所示装置,探究固体的成分。

(1)若用装置A、B组合进行实验,B中无现象,则猜想
(2)若用装置A、C组合进行实验,C中无现象,则猜想
(3)小组同学将装置按A、
(四)实验结论:固体为
 和
和 的混合物。
的混合物。经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的
 溶液和一定量
溶液和一定量 反应的离子方程式
反应的离子方程式
您最近一年使用:0次
名校
8 . 下列物质的性质与用途具有对应关系正确的是
A. 属于碱性氧化物,可用于制备少量氧气 属于碱性氧化物,可用于制备少量氧气 |
| B.NaClO有强氧化性,可用于对环境消毒 |
C. 溶液显碱性,可用于去除矿物油(如煤油、柴油)的油污 溶液显碱性,可用于去除矿物油(如煤油、柴油)的油污 |
D. 具有还原性,可用于吸收含 具有还原性,可用于吸收含 的尾气 的尾气 |
您最近一年使用:0次
名校
解题方法
9 . 在 中加入蒸馏水,微热,
中加入蒸馏水,微热, 完全水解,产物之一是亚磷酸
完全水解,产物之一是亚磷酸 。
。
 易溶于水,它的结构式表示为
易溶于水,它的结构式表示为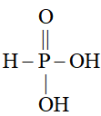 。
。 和
和 反应只生成
反应只生成 和
和 两种盐,其正盐溶液呈碱性。常温下,
两种盐,其正盐溶液呈碱性。常温下, 的亚磷酸溶液pH约为1。在
的亚磷酸溶液pH约为1。在 溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄
溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄 色沉淀析出。若在装有
色沉淀析出。若在装有 溶液的试管中加入
溶液的试管中加入 溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:
溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:
(1) 为
为__________ 盐(填“酸式”、“碱式”或“正”)。
(2)用化学方程式表示 和碘水的反应:
和碘水的反应:_______________ 。
 水溶液呈碱性的原因(用离子方程式表示):
水溶液呈碱性的原因(用离子方程式表示):_____________ 。
(3)根据上述事实,可以得知 是
是______ (填序号)。
A.强酸 B.弱酸 C.二元酸 D.三元酸 E.具有强氧化性 F.具有强还原性
 中加入蒸馏水,微热,
中加入蒸馏水,微热, 完全水解,产物之一是亚磷酸
完全水解,产物之一是亚磷酸 。
。 易溶于水,它的结构式表示为
易溶于水,它的结构式表示为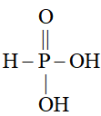 。
。 和
和 反应只生成
反应只生成 和
和 两种盐,其正盐溶液呈碱性。常温下,
两种盐,其正盐溶液呈碱性。常温下,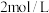 的亚磷酸溶液pH约为1。在
的亚磷酸溶液pH约为1。在 溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄
溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄 色沉淀析出。若在装有
色沉淀析出。若在装有 溶液的试管中加入
溶液的试管中加入 溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:
溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:(1)
 为
为(2)用化学方程式表示
 和碘水的反应:
和碘水的反应: 水溶液呈碱性的原因(用离子方程式表示):
水溶液呈碱性的原因(用离子方程式表示):(3)根据上述事实,可以得知
 是
是A.强酸 B.弱酸 C.二元酸 D.三元酸 E.具有强氧化性 F.具有强还原性
您最近一年使用:0次
名校
解题方法
10 . 下列物质的性质与用途具有对应关系的是
| A.Na2CO3溶液显碱性,可用于除食用油的油污 |
| B.NaHCO3受热易分解,可用于治疗胃酸过多 |
| C.NaClO 有强氧化性,可用于对自来水进行杀菌消毒 |
| D.Na2SO3具有还原性,可用于吸收含SO2的尾气 |
您最近一年使用:0次




