名校
1 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
已知:①“焙烧”中, 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐;②
转化为相应的硫酸盐;② 。回答下列问题:
。回答下列问题:
(1)为了加快“焙烧”速率,可采用的物理方法为______ (填一种即可)。
(2) “焙烧”时,转化为
“焙烧”时,转化为 ;在
;在 的
的 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为______ (填离子符号)。
(3)“水浸”后的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最先析出的离子为______ (填离子符号)。
(4)水浸渣在160℃“酸溶”,最适合的加热方式为______ (填“水浴”或“油浴”)加热。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。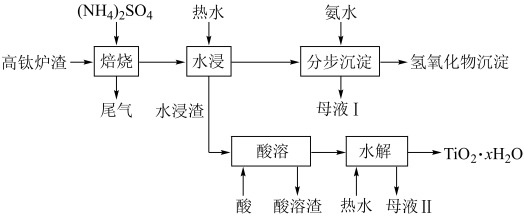
金属离子 |
|
|
|
|
开始沉淀( | 1.5 | 3.4 | 8.9 | 12.0 |
沉淀完全( | 2.8 | 4.7 | 10.9 | 13.8 |
 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐;②
转化为相应的硫酸盐;② 。回答下列问题:
。回答下列问题:(1)为了加快“焙烧”速率,可采用的物理方法为
(2)
 “焙烧”时,转化为
“焙烧”时,转化为 ;在
;在 的
的 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为(3)“水浸”后的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最先析出的离子为
(4)水浸渣在160℃“酸溶”,最适合的加热方式为
(5)“酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 某小组同学探究盐对 平衡体系的影响。
平衡体系的影响。
实验I:探究 对
对 和
和 平衡体系的影响
平衡体系的影响
将等体积、低浓度的
 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和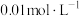
 溶液混合,静置至体系达平衡,得红色溶液
溶液混合,静置至体系达平衡,得红色溶液 。各取3mL溶液
。各取3mL溶液 放入3只比色皿中,分别滴加0.1mL不同浓度的
放入3只比色皿中,分别滴加0.1mL不同浓度的 溶液,并测定各溶液的透光率随时间的变化,结果如下图。
溶液,并测定各溶液的透光率随时间的变化,结果如下图。
② 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。
(1)稀盐酸酸化 溶液的目的是
溶液的目的是___________ 。采用浓度较低的 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看, 溶液确实对
溶液确实对 和
和 平衡体系有影响,且随着
平衡体系有影响,且随着 浓度增大,
浓度增大, 平衡向
平衡向___________ (填“正”或“逆”)反应方向移动。
实验Ⅱ:探究盐对 和
和 平衡体系产生影响的原因
平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。 溶液的加入使
溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液 ,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
①上述实验可证明盐效应影响了 和
和 平衡体系的是
平衡体系的是___________ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验___________ (填序号)可得出结论: 的盐效应弱于
的盐效应弱于 的盐效应。简述选择实验的理由及获得结论的依据:
的盐效应。简述选择实验的理由及获得结论的依据:___________ 。
(4)取等体积的溶液 继续进行实验,结果如下表。
继续进行实验,结果如下表。
上述实验可证明副反应影响了 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:___________ 。
 平衡体系的影响。
平衡体系的影响。实验I:探究
 对
对 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的

 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和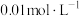
 溶液混合,静置至体系达平衡,得红色溶液
溶液混合,静置至体系达平衡,得红色溶液 。各取3mL溶液
。各取3mL溶液 放入3只比色皿中,分别滴加0.1mL不同浓度的
放入3只比色皿中,分别滴加0.1mL不同浓度的 溶液,并测定各溶液的透光率随时间的变化,结果如下图。
溶液,并测定各溶液的透光率随时间的变化,结果如下图。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,
 溶液确实对
溶液确实对 和
和 平衡体系有影响,且随着
平衡体系有影响,且随着 浓度增大,
浓度增大, 平衡向
平衡向实验Ⅱ:探究盐对
 和
和 平衡体系产生影响的原因
平衡体系产生影响的原因同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
 溶液的加入使
溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液
 ,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。| 序号 | 加入少量盐溶液 | 颜色 |
| 1 | 无 | 红色 |
| 2 |  | 变浅 |
| 3 |  | 略变浅 |
| 4 |  | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。简述选择实验的理由及获得结论的依据:
的盐效应。简述选择实验的理由及获得结论的依据:(4)取等体积的溶液
 继续进行实验,结果如下表。
继续进行实验,结果如下表。| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:
您最近一年使用:0次
名校
3 . 锶( )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为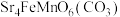 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化: 均不能形成配合物。请回答:
均不能形成配合物。请回答:
(1)写出溶液C中的所有阳离子___________ 。
(2)步骤Ⅴ中的反应为 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②___________ 。
(3)下列说法不正确 的是___________。
(4)固体Y可与 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式___________ 。
(5)设计实验方案检验气体中除 以外的两种主要成分
以外的两种主要成分___________ 。
 )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为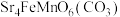 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化:
 均不能形成配合物。请回答:
均不能形成配合物。请回答:(1)写出溶液C中的所有阳离子
(2)步骤Ⅴ中的反应为
 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②(3)下列说法
A.固体B中含有 | B.步骤Ⅱ反应促进了 的水解 的水解 |
C.步骤Ⅲ可推断碱性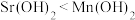 | D.直接加热 无法获得 无法获得 |
(4)固体Y可与
 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式(5)设计实验方案检验气体中除
 以外的两种主要成分
以外的两种主要成分
您最近一年使用:0次
名校
解题方法
4 .  是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:_______ 。
(2)仪器 的名称为
的名称为_______ 。
(3)实验前,应先检查装置的气密性,检查的方法为_______ 。
(4)装置Ⅰ中发生反应的化学方程式为_______ 。
(5)用电子式表示 的形成过程:
的形成过程:_______ 。
(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ. 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。
① 属于
属于_______ (填“离子”或“共价”)化合物。
②该小组乙同学认为猜想ⅰ错误,判断的理由为_______ 。
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为_______ (用离子方程式表示)。
 是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题: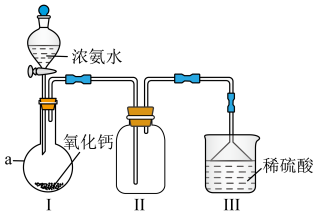
(2)仪器
 的名称为
的名称为(3)实验前,应先检查装置的气密性,检查的方法为
(4)装置Ⅰ中发生反应的化学方程式为
(5)用电子式表示
 的形成过程:
的形成过程:(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ.
 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。①
 属于
属于②该小组乙同学认为猜想ⅰ错误,判断的理由为
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为
您最近一年使用:0次
2024-05-24更新
|
60次组卷
|
2卷引用:湖南省长沙市第一中学、长沙市一中城南中学等多校2023-2024学年高二下学期期中考试化学试题
5 . 物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,请回答:
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为_______ 。
(2)t℃时,某稀硫酸溶液中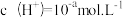 ,
,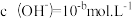 ,已知:
,已知: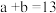 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为_______ 。
(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为_______ 。
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
pH 相同的①CH3COONa 溶液、② NaClO溶液、③ NaHCO3溶液、④ NaOH 溶液,其物质的量浓度由大到小的顺序为_______ 。
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
为制备CuCl2·3H2O,除去Cu2+、Fe2+、Fe3+离子应该先加入_______ ,然后再加入_______ ,调节pH 范围为_______ 。
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为
(2)t℃时,某稀硫酸溶液中
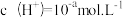 ,
,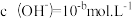 ,已知:
,已知: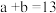 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 |  | 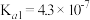 | 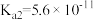 | 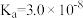 |
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
您最近一年使用:0次
名校
6 . 以煤为主要原料可以制备乙二醇,相关工艺流程如图:

①该反应能够自发进行,可以推出a_______ 0;(填“>”“<”或“=”)。
②在一定温度下,向体积为1L的恒容密闭容器中充入2mol 和3mol
和3mol ,反应前后压强之比为15∶7,则该温度下的化学平衡常数
,反应前后压强之比为15∶7,则该温度下的化学平衡常数
_______ 。
(2)方法2:在恒容密闭容器中投入草酸二甲酯和 发生如下反应:
发生如下反应:


为提高乙二醇的产量和速率,宜采用的措施是_______ (填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(3)草酸二甲酯水解生成草酸:
①设计实验证明草酸为弱酸的方案及其现象均正确的有_______ 。
A.室温下,取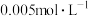 的
的 溶液,测其
溶液,测其
B.室温下,取 的
的 溶液,测其
溶液,测其
C.室温下,取 的
的 溶液稀释100倍后,测其
溶液稀释100倍后,测其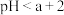
D.标准状况下,取 的
的 溶液100mL与足量锌粉反应,收集到
溶液100mL与足量锌粉反应,收集到 体积为224mL
体积为224mL
② 溶液显
溶液显_______ (填“酸性”、“中性”或“碱性”),溶液中各离子浓度从大到小的顺序为_______ 。
(4)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_______ (填“正”或“负”)极,负极反应式为_______ 。
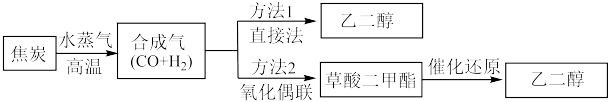


①该反应能够自发进行,可以推出a
②在一定温度下,向体积为1L的恒容密闭容器中充入2mol
 和3mol
和3mol ,反应前后压强之比为15∶7,则该温度下的化学平衡常数
,反应前后压强之比为15∶7,则该温度下的化学平衡常数
(2)方法2:在恒容密闭容器中投入草酸二甲酯和
 发生如下反应:
发生如下反应:

为提高乙二醇的产量和速率,宜采用的措施是
A.升高温度 B.增大压强 C.增大氢气浓度
(3)草酸二甲酯水解生成草酸:

①设计实验证明草酸为弱酸的方案及其现象均正确的有
A.室温下,取
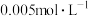 的
的 溶液,测其
溶液,测其
B.室温下,取
 的
的 溶液,测其
溶液,测其
C.室温下,取
 的
的 溶液稀释100倍后,测其
溶液稀释100倍后,测其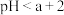
D.标准状况下,取
 的
的 溶液100mL与足量锌粉反应,收集到
溶液100mL与足量锌粉反应,收集到 体积为224mL
体积为224mL②
 溶液显
溶液显(4)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的
您最近一年使用:0次
7 . 草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数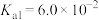 ,
,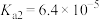 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.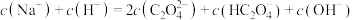
b.
c.
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。
①需托盘天平称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②样品中 的质量分数为
的质量分数为___________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数___________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数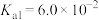 ,
,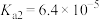 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
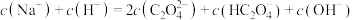
b.

c.

d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。①需托盘天平称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②样品中
 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近一年使用:0次
8 . 水资源的处理和利用是环境化学的重要课题。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是___________ (用离子方程式说明)。几种均为0.1mol L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 ___________ (填罗马数字),判断的理由是 ___________ 。
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为___________ 。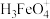 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=___________ 。
(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是
 L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 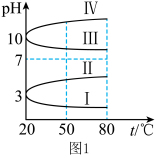
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为

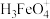 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。
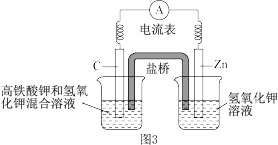

②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
您最近一年使用:0次
名校
解题方法
9 . 化学上的缓冲溶液就是外加少量酸、碱后而pH值基本不变的溶液。
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式___________ 、___________ 。
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为___________ ,反应后溶液中c(H+)=___________ mol/L。
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为___________ ;c点恰好完全反应,该处溶液呈碱性的原因为___________ 。
4.CO2的电子式为___________ ,其分子极性为___________ ;电负性C___________ Si(填“>”“=”或者“<”)。
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是___________ 。
a.代谢产生的H+被 结合形成H2CO3
结合形成H2CO3
b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为
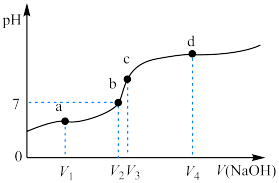
4.CO2的电子式为
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是
a.代谢产生的H+被
 结合形成H2CO3
结合形成H2CO3b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
您最近一年使用:0次
名校
10 . I.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)CO 的空间结构是
的空间结构是_______ 。
(2) 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”)。
(3)物质的量浓度均为0.1mol·L−1的下列四种溶液:pH由小到大 排列的顺序是_______ 。(填序号)
①CH3COONa②Na2CO3③NaClO④NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_______ 。
II.为实现“双碳”目标,用二氧化碳制备甲醇可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
已知:反应1:

反应2:
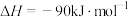
(5)则反应3: 催化加氢制取
催化加氢制取 的热化学方程式为
的热化学方程式为_______ 。
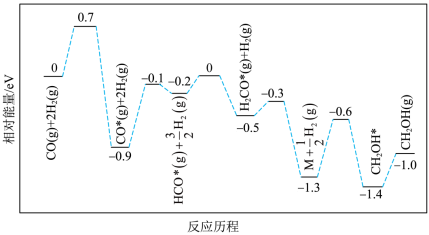
(6)反应2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。_______ 。
III.为了探究电解池的工作原理,某研究性学习小组用下图所示的装置进行实验。实验时该小组同学发现两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根( )在溶液中呈紫红色。
)在溶液中呈紫红色。
(7)电解过程中,Y极发生的电极反应为_______ 、_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.810−5 | Kal=4.310−7、Ka2=5.610−11 | Ka=3.010−8 |
 的空间结构是
的空间结构是(2)
 溶液呈
溶液呈(3)物质的量浓度均为0.1mol·L−1的下列四种溶液:pH
①CH3COONa②Na2CO3③NaClO④NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
II.为实现“双碳”目标,用二氧化碳制备甲醇可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
已知:反应1:


反应2:

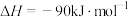
(5)则反应3:
 催化加氢制取
催化加氢制取 的热化学方程式为
的热化学方程式为(6)反应2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。
III.为了探究电解池的工作原理,某研究性学习小组用下图所示的装置进行实验。实验时该小组同学发现两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
(7)电解过程中,Y极发生的电极反应为
您最近一年使用:0次




 )的pH
)的pH )的pH
)的pH

