解题方法
1 . 处理废旧铅酸电池中的含铅浆液(主要含 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。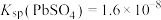 ,
,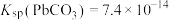 ,
,
ii. 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。
(1)向含铅浆液中加入过量的 实现转化脱硫。
实现转化脱硫。
①结合离子方程式说明 溶液显碱性的原因:
溶液显碱性的原因:________ 。
②转化脱硫反应的离子方程式是________ 。
③检验 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是________ 。
(2)受热时, 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。
将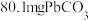 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中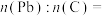
________ 。[ 、
、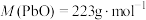 ]
]
(3)“还原”时加入 溶液,反应的化学方程式是
溶液,反应的化学方程式是________ 。
(4)“浸出”反应的离子方程式是________ 。
(5)以惰性电极电解 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是________ 。
 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。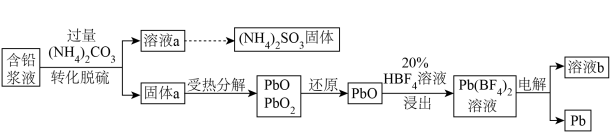
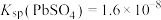 ,
,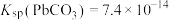 ,
,ii.
 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。(1)向含铅浆液中加入过量的
 实现转化脱硫。
实现转化脱硫。①结合离子方程式说明
 溶液显碱性的原因:
溶液显碱性的原因:②转化脱硫反应的离子方程式是
③检验
 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是(2)受热时,
 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。将
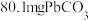 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中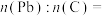
 、
、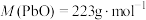 ]
](3)“还原”时加入
 溶液,反应的化学方程式是
溶液,反应的化学方程式是(4)“浸出”反应的离子方程式是
(5)以惰性电极电解
 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是
您最近一年使用:0次
解题方法
2 .  作牙膏的添加剂可预防龋齿,通常以氟化钠(NaF)与三偏磷酸钠(
作牙膏的添加剂可预防龋齿,通常以氟化钠(NaF)与三偏磷酸钠( )在熔融条件下反应制得。
)在熔融条件下反应制得。
(1)基态F原子的价层电子排布式为________ 。
(2)基态O原子中,电子占据的最高能层的符号是________ ,处于最高能级的电子的运动状态共有________ 个。
(3)两个 分子间可以通过脱水缩合生成焦磷酸:
分子间可以通过脱水缩合生成焦磷酸: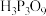 )可由
)可由 分子间脱水生成,
分子间脱水生成,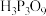 分子中3个P原子的化学环境相同,
分子中3个P原子的化学环境相同,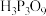 的结构式是
的结构式是________ 。
(4) 溶于水时与水反应,P-F键断裂,生成
溶于水时与水反应,P-F键断裂,生成 。
。
① 中磷元素的化合价是
中磷元素的化合价是________ 价。
②该反应会形成________ (填“P-O”或“P-H”)键。
③反应后,溶液中粒子浓度的关系:
________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)牙膏中可添加 作摩擦剂,其晶胞结构如下图所示,晶胞的边长为apm。
作摩擦剂,其晶胞结构如下图所示,晶胞的边长为apm。 ,该晶体的密度为
,该晶体的密度为________  。(
。( )
)
 作牙膏的添加剂可预防龋齿,通常以氟化钠(NaF)与三偏磷酸钠(
作牙膏的添加剂可预防龋齿,通常以氟化钠(NaF)与三偏磷酸钠( )在熔融条件下反应制得。
)在熔融条件下反应制得。(1)基态F原子的价层电子排布式为
(2)基态O原子中,电子占据的最高能层的符号是
(3)两个
 分子间可以通过脱水缩合生成焦磷酸:
分子间可以通过脱水缩合生成焦磷酸:
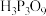 )可由
)可由 分子间脱水生成,
分子间脱水生成,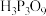 分子中3个P原子的化学环境相同,
分子中3个P原子的化学环境相同,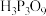 的结构式是
的结构式是(4)
 溶于水时与水反应,P-F键断裂,生成
溶于水时与水反应,P-F键断裂,生成 。
。①
 中磷元素的化合价是
中磷元素的化合价是②该反应会形成
③反应后,溶液中粒子浓度的关系:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)牙膏中可添加
 作摩擦剂,其晶胞结构如下图所示,晶胞的边长为apm。
作摩擦剂,其晶胞结构如下图所示,晶胞的边长为apm。
 ,该晶体的密度为
,该晶体的密度为 。(
。( )
)
您最近一年使用:0次
解题方法
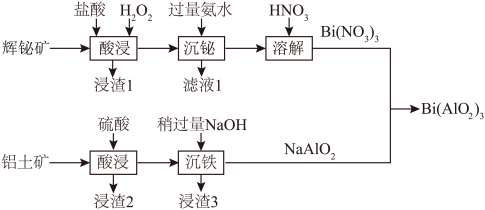
3 . 铝酸铋[Bi(AlO2)3]是一种能够有效调理胃肠功能、促进疾病恢复的常见药物,常用辉铋矿(主要成分为Bi2S3,还含少量Cu2S和Ag2O)和铝土矿(主要成分为Al2O3,还含少量Fe2O3和SiO2)利用如下流程制取:
② BiCl3易溶于水,易水解,Bi(OH)3不溶于水和碱。
回答下列问题:
(1)辉铋矿“酸浸”过程中,需要控制温度不超过50℃的原因是_______ 。
(2)辉铋矿“酸浸”时S元素转化为单质硫,浸渣1的成分为_______ 。“酸浸”时Bi2S3转化的离子方程式为_______ 。
(3)“沉铋”时氨水稍过量的目的是_______ ;“沉铁”时稍过量的NaOH能否用氨水代替:_______ (填“能”或“否”)。
(4)Bi(NO3)3溶液和NaAlO2溶液混合前,Bi(NO3)3溶液中往往含少量硝酸,NaAlO2溶液中往往含少量NaOH,其目的是_______ 。
(5)Bi(NO3)3溶液和NaAlO2溶液混合充分反应,写出制取Bi(AlO2)3的化学方程式_______ ,利用1 kg含77.1% Bi2S3的辉铋矿与足量铝土矿作用制得868.5 g Bi(AlO2)3,则铝酸铋的产率为_______ 。
② BiCl3易溶于水,易水解,Bi(OH)3不溶于水和碱。
回答下列问题:
(1)辉铋矿“酸浸”过程中,需要控制温度不超过50℃的原因是
(2)辉铋矿“酸浸”时S元素转化为单质硫,浸渣1的成分为
(3)“沉铋”时氨水稍过量的目的是
(4)Bi(NO3)3溶液和NaAlO2溶液混合前,Bi(NO3)3溶液中往往含少量硝酸,NaAlO2溶液中往往含少量NaOH,其目的是
(5)Bi(NO3)3溶液和NaAlO2溶液混合充分反应,写出制取Bi(AlO2)3的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 铜(Ⅰ)配合物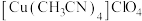 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。
Ⅰ. 制备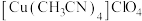
将乙腈 、
、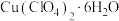 、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
取 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。
已知:① 沸点为81℃,酸性条件下生成醋酸(
沸点为81℃,酸性条件下生成醋酸( )和铵盐(
)和铵盐( )
)
②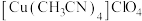 (
( )较易被空气氧化;
)较易被空气氧化;
③EDTA与 形成
形成 配合物;
配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是______ ;b中应加入______ 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是____________ 。
(3)“一系列操作”依次为______ (操作名称)、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4) 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为____________ 。
(5)加入醋酸钠溶液的主要目的是____________ 。
(6)测得产品的纯度为____________ (用含m、c、V的代数式表示)。
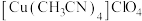 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。Ⅰ. 制备
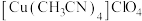
将乙腈
 、
、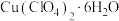 、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
取
 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。已知:①
 沸点为81℃,酸性条件下生成醋酸(
沸点为81℃,酸性条件下生成醋酸( )和铵盐(
)和铵盐( )
)②
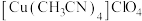 (
( )较易被空气氧化;
)较易被空气氧化;③EDTA与
 形成
形成 配合物;
配合物;④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是
(2)加入过量铜粉能提高产物的纯度,可能的原因是
(3)“一系列操作”依次为
(4)
 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为(5)加入醋酸钠溶液的主要目的是
(6)测得产品的纯度为
您最近一年使用:0次
解题方法
5 . 火法炼铜过程中产生的副产品白烟尘常含有ZnO、 、CuO、CdO、
、CuO、CdO、 、PbO等固体物质,白烟尘综合利用可提高资源利用率,保护环境,其工艺流程如图所示。
、PbO等固体物质,白烟尘综合利用可提高资源利用率,保护环境,其工艺流程如图所示。
①常温下, 的溶解度是
的溶解度是 ,
, 的溶解度是1g。
的溶解度是1g。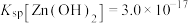 ,
, 。
。
② 易溶于盐酸,生成
易溶于盐酸,生成 :
: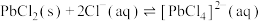 。
。
③胶体对 、
、 有吸附作用。
有吸附作用。
回答下列问题:
(1)酸浸过程得到的浸出液中,砷元素主要以 的形式存在,
的形式存在, 中As的化合价为
中As的化合价为___________ 。
(2)用硫酸、混酸(硫酸与盐酸)体系分别对白烟尘进行直接浸出,实验结果显示混酸体系可以进一步提高As、Cd的浸出率,但会导致铅的溶解,铅溶解的原因是___________ 。
(3)表1、表2是在其他条件一定时,铁铜摩尔置换比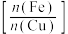 、温度对铜的置换率和品位(固体产物中所含某种金属或有用成分的多少)的影响。
、温度对铜的置换率和品位(固体产物中所含某种金属或有用成分的多少)的影响。
表1铁铜摩尔置换比对铜置换率和品位的影响
表2温度对铜置换率和品位的影响
①从浸出液中置换铜的最佳铁铜摩尔置换比和最佳温度分别是___________ 。
②铁置换铜的铁铜摩尔置换比要比理论值1.0高,可能的原因是___________ 。
(4)在一定条件下,研究初始pH对沉砷率的影响,在pH=2时,稳定在98%左右,随着pH增大和温度升高,锌和镉的损失明显增加,原因是___________ 。
(5)写出“沉锌镉”时生成 的离子方程式:
的离子方程式:___________ 。若常温下“沉锌镉”后滤液中 的浓度降低为
的浓度降低为 ,此时滤液的pH为
,此时滤液的pH为___________ 。
(6)向锌镉沉淀中加入NaOH溶液,调整pH至12, 沉淀溶解,则该反应的离子方程式为
沉淀溶解,则该反应的离子方程式为___________ 。
 、CuO、CdO、
、CuO、CdO、 、PbO等固体物质,白烟尘综合利用可提高资源利用率,保护环境,其工艺流程如图所示。
、PbO等固体物质,白烟尘综合利用可提高资源利用率,保护环境,其工艺流程如图所示。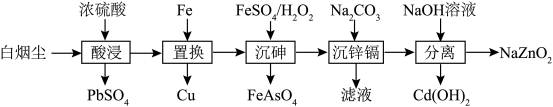
①常温下,
 的溶解度是
的溶解度是 ,
, 的溶解度是1g。
的溶解度是1g。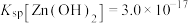 ,
, 。
。②
 易溶于盐酸,生成
易溶于盐酸,生成 :
: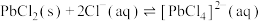 。
。③胶体对
 、
、 有吸附作用。
有吸附作用。回答下列问题:
(1)酸浸过程得到的浸出液中,砷元素主要以
 的形式存在,
的形式存在, 中As的化合价为
中As的化合价为(2)用硫酸、混酸(硫酸与盐酸)体系分别对白烟尘进行直接浸出,实验结果显示混酸体系可以进一步提高As、Cd的浸出率,但会导致铅的溶解,铅溶解的原因是
(3)表1、表2是在其他条件一定时,铁铜摩尔置换比
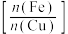 、温度对铜的置换率和品位(固体产物中所含某种金属或有用成分的多少)的影响。
、温度对铜的置换率和品位(固体产物中所含某种金属或有用成分的多少)的影响。表1铁铜摩尔置换比对铜置换率和品位的影响
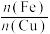 | 置换率/% | Cu品位/% |
| 1.2 | 74.87 | 51.22 |
| 1.4 | 92.17 | 72.82 |
| 1.6 | 99.92 | 72.08 |
| 温度/℃ | 置换率/% | Cu品位/% |
| 30 | 99.92 | 72.08 |
| 60 | 99.93 | 70.34 |
| 80 | 99.86 | 69.98 |
②铁置换铜的铁铜摩尔置换比要比理论值1.0高,可能的原因是
(4)在一定条件下,研究初始pH对沉砷率的影响,在pH=2时,稳定在98%左右,随着pH增大和温度升高,锌和镉的损失明显增加,原因是
(5)写出“沉锌镉”时生成
 的离子方程式:
的离子方程式: 的浓度降低为
的浓度降低为 ,此时滤液的pH为
,此时滤液的pH为(6)向锌镉沉淀中加入NaOH溶液,调整pH至12,
 沉淀溶解,则该反应的离子方程式为
沉淀溶解,则该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 .  是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:_______ 。
(2)仪器 的名称为
的名称为_______ 。
(3)实验前,应先检查装置的气密性,检查的方法为_______ 。
(4)装置Ⅰ中发生反应的化学方程式为_______ 。
(5)用电子式表示 的形成过程:
的形成过程:_______ 。
(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ. 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。
① 属于
属于_______ (填“离子”或“共价”)化合物。
②该小组乙同学认为猜想ⅰ错误,判断的理由为_______ 。
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为_______ (用离子方程式表示)。
 是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题: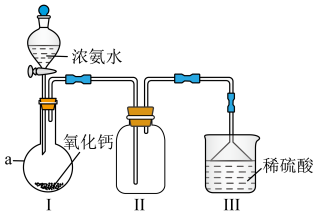
(2)仪器
 的名称为
的名称为(3)实验前,应先检查装置的气密性,检查的方法为
(4)装置Ⅰ中发生反应的化学方程式为
(5)用电子式表示
 的形成过程:
的形成过程:(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ.
 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。①
 属于
属于②该小组乙同学认为猜想ⅰ错误,判断的理由为
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为
您最近一年使用:0次
7 . 物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,请回答:
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为_______ 。
(2)t℃时,某稀硫酸溶液中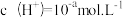 ,
,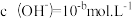 ,已知:
,已知: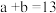 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为_______ 。
(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为_______ 。
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
pH 相同的①CH3COONa 溶液、② NaClO溶液、③ NaHCO3溶液、④ NaOH 溶液,其物质的量浓度由大到小的顺序为_______ 。
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
为制备CuCl2·3H2O,除去Cu2+、Fe2+、Fe3+离子应该先加入_______ ,然后再加入_______ ,调节pH 范围为_______ 。
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为
(2)t℃时,某稀硫酸溶液中
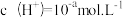 ,
,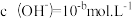 ,已知:
,已知: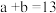 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 |  | 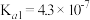 | 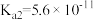 | 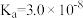 |
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
您最近一年使用:0次
名校
8 . 以煤为主要原料可以制备乙二醇,相关工艺流程如图:

①该反应能够自发进行,可以推出a_______ 0;(填“>”“<”或“=”)。
②在一定温度下,向体积为1L的恒容密闭容器中充入2mol 和3mol
和3mol ,反应前后压强之比为15∶7,则该温度下的化学平衡常数
,反应前后压强之比为15∶7,则该温度下的化学平衡常数
_______ 。
(2)方法2:在恒容密闭容器中投入草酸二甲酯和 发生如下反应:
发生如下反应:


为提高乙二醇的产量和速率,宜采用的措施是_______ (填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(3)草酸二甲酯水解生成草酸:
①设计实验证明草酸为弱酸的方案及其现象均正确的有_______ 。
A.室温下,取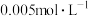 的
的 溶液,测其
溶液,测其
B.室温下,取 的
的 溶液,测其
溶液,测其
C.室温下,取 的
的 溶液稀释100倍后,测其
溶液稀释100倍后,测其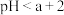
D.标准状况下,取 的
的 溶液100mL与足量锌粉反应,收集到
溶液100mL与足量锌粉反应,收集到 体积为224mL
体积为224mL
② 溶液显
溶液显_______ (填“酸性”、“中性”或“碱性”),溶液中各离子浓度从大到小的顺序为_______ 。
(4)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_______ (填“正”或“负”)极,负极反应式为_______ 。
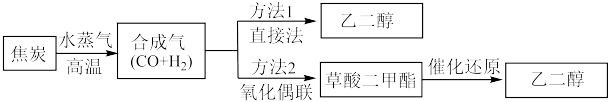


①该反应能够自发进行,可以推出a
②在一定温度下,向体积为1L的恒容密闭容器中充入2mol
 和3mol
和3mol ,反应前后压强之比为15∶7,则该温度下的化学平衡常数
,反应前后压强之比为15∶7,则该温度下的化学平衡常数
(2)方法2:在恒容密闭容器中投入草酸二甲酯和
 发生如下反应:
发生如下反应:

为提高乙二醇的产量和速率,宜采用的措施是
A.升高温度 B.增大压强 C.增大氢气浓度
(3)草酸二甲酯水解生成草酸:

①设计实验证明草酸为弱酸的方案及其现象均正确的有
A.室温下,取
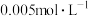 的
的 溶液,测其
溶液,测其
B.室温下,取
 的
的 溶液,测其
溶液,测其
C.室温下,取
 的
的 溶液稀释100倍后,测其
溶液稀释100倍后,测其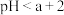
D.标准状况下,取
 的
的 溶液100mL与足量锌粉反应,收集到
溶液100mL与足量锌粉反应,收集到 体积为224mL
体积为224mL②
 溶液显
溶液显(4)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的
您最近一年使用:0次
9 . 草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数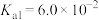 ,
,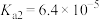 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.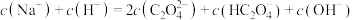
b.
c.
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。
①需托盘天平称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②样品中 的质量分数为
的质量分数为___________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数___________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数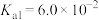 ,
,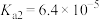 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
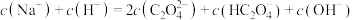
b.

c.

d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。①需托盘天平称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②样品中
 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近一年使用:0次
10 . 水资源的处理和利用是环境化学的重要课题。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是___________ (用离子方程式说明)。几种均为0.1mol L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 ___________ (填罗马数字),判断的理由是 ___________ 。
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为___________ 。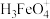 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=___________ 。
(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是
 L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 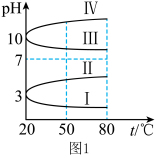
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为

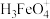 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。
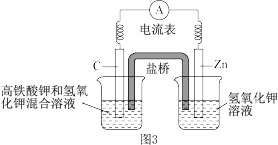

②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
您最近一年使用:0次



