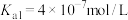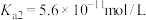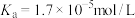解题方法
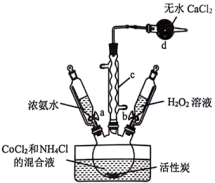
1 . 含钴配合物在催化、药物和材料科学领域具有广泛应用,在不同的制备条件下,钴可以形成多种配位结构。三氯化六氨合钴(Ⅲ)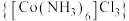 是一种重要的含钴配合物,实验室可用活性炭为催化剂,由
是一种重要的含钴配合物,实验室可用活性炭为催化剂,由 、浓氨水、
、浓氨水、 、
、 制备。
制备。
已知:① 在溶液中较稳定;
在溶液中较稳定; 具有较强还原性;
具有较强还原性;
②常温下,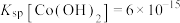 。
。
实验过程操作步骤如下(省略加热和夹持装置): 固体溶在水中,加入研细的
固体溶在水中,加入研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。
步骤2:实验装置如图,将混合溶液转移至三颈烧瓶中,加入活性炭,再加入 溶液与浓氨水,水浴加热至55℃,保持20min。
溶液与浓氨水,水浴加热至55℃,保持20min。
步骤3:趁热过滤,冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到 粗产品。
粗产品。
回答下列问题:
(1)仪器c的名称是______ ,d中无水 的作用是
的作用是______ 。
(2)步骤1中,加入 有利于后续配离子的生成,其原因是
有利于后续配离子的生成,其原因是______ 。
(3)步骤2中,加入 溶液与浓氨水时,应先打开活塞
溶液与浓氨水时,应先打开活塞______ (填“a”或“b”)。
(4)步骤3中加入浓盐酸的目的是______ 。
(5) 制备
制备 的总反应化学方程式为
的总反应化学方程式为______ 。
(6)已知 是以
是以 为中心的正八面体结构(如图所示),若其中2个
为中心的正八面体结构(如图所示),若其中2个 被
被 取代,则所形成的
取代,则所形成的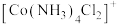 的空间结构有
的空间结构有______ 种。 ,向含0.1mol该配合物溶液中加入足量
,向含0.1mol该配合物溶液中加入足量 溶液,得到白色沉淀28.7g,其配离子的化学式为
溶液,得到白色沉淀28.7g,其配离子的化学式为______ 。
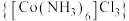 是一种重要的含钴配合物,实验室可用活性炭为催化剂,由
是一种重要的含钴配合物,实验室可用活性炭为催化剂,由 、浓氨水、
、浓氨水、 、
、 制备。
制备。已知:①
 在溶液中较稳定;
在溶液中较稳定; 具有较强还原性;
具有较强还原性;②常温下,
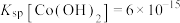 。
。实验过程操作步骤如下(省略加热和夹持装置):
 固体溶在水中,加入研细的
固体溶在水中,加入研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。步骤2:实验装置如图,将混合溶液转移至三颈烧瓶中,加入活性炭,再加入
 溶液与浓氨水,水浴加热至55℃,保持20min。
溶液与浓氨水,水浴加热至55℃,保持20min。步骤3:趁热过滤,冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到
 粗产品。
粗产品。回答下列问题:
(1)仪器c的名称是
 的作用是
的作用是(2)步骤1中,加入
 有利于后续配离子的生成,其原因是
有利于后续配离子的生成,其原因是(3)步骤2中,加入
 溶液与浓氨水时,应先打开活塞
溶液与浓氨水时,应先打开活塞(4)步骤3中加入浓盐酸的目的是
(5)
 制备
制备 的总反应化学方程式为
的总反应化学方程式为(6)已知
 是以
是以 为中心的正八面体结构(如图所示),若其中2个
为中心的正八面体结构(如图所示),若其中2个 被
被 取代,则所形成的
取代,则所形成的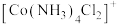 的空间结构有
的空间结构有
 ,向含0.1mol该配合物溶液中加入足量
,向含0.1mol该配合物溶液中加入足量 溶液,得到白色沉淀28.7g,其配离子的化学式为
溶液,得到白色沉淀28.7g,其配离子的化学式为
您最近一年使用:0次
名校
解题方法
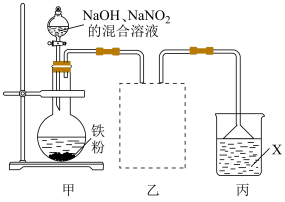
2 . 钢铁表面发黑(在钢铁表面形成一层致密的氧化物膜)可提高其耐磨、耐腐蚀性能。某实验小组欲利用下列装置进行发黑实验,并探究氧化物成分。
(1)实验开始前需将铁粉依次放入热的碳酸钠溶液和饱和氯化铵溶液中进行处理,其目的分别是___________ 和___________ 。
(2)向圆底烧瓶中逐滴滴入 、
、 的混合溶液至过量,在140℃下处理15~90min。
的混合溶液至过量,在140℃下处理15~90min。
①盛装混合溶液的仪器为___________ 。
②下列加热方法中,最合适的为___________ (填标号)。
A.水浴 B.油浴 C.酒精灯
(3)用乙装置收集产生的气体,请在装置中补全仪器。___________
(4)试剂X可以为___________ 。
(5)探究甲装置中固体产物(无铁单质剩余)成分。
取少量洗涤后的固体产物于试管中,滴入足量的稀硫酸,实验中固体全部溶解,无气体生成。将生成的溶液分成两份,分装于a、b两支试管中。
①向a试管中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明a试管中含有___________ (填离子符号)。
②不用硝酸溶解固体的原因为___________ 。
③向b试管中滴入___________ (填化学式)溶液,溶液变为血红色,说明b试管中含有___________ (填离子符号)。
(6)根据以上信息,推测圆底烧瓶中进行发黑实验时可能发生反应的化学方程式:___________ 。
(1)实验开始前需将铁粉依次放入热的碳酸钠溶液和饱和氯化铵溶液中进行处理,其目的分别是
(2)向圆底烧瓶中逐滴滴入
 、
、 的混合溶液至过量,在140℃下处理15~90min。
的混合溶液至过量,在140℃下处理15~90min。①盛装混合溶液的仪器为
②下列加热方法中,最合适的为
A.水浴 B.油浴 C.酒精灯
(3)用乙装置收集产生的气体,请在装置中补全仪器。
(4)试剂X可以为
(5)探究甲装置中固体产物(无铁单质剩余)成分。
取少量洗涤后的固体产物于试管中,滴入足量的稀硫酸,实验中固体全部溶解,无气体生成。将生成的溶液分成两份,分装于a、b两支试管中。
①向a试管中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明a试管中含有
②不用硝酸溶解固体的原因为
③向b试管中滴入
(6)根据以上信息,推测圆底烧瓶中进行发黑实验时可能发生反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
379次组卷
|
4卷引用:辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题
名校
解题方法
3 . 已知25 ℃时某些酸碱的电离常数见下表,回答下列问题:
(1)25℃将pH=4醋酸和pH=10氨水等体积混合,所得溶液pH___________ 7(填“>”、“<”或“=”);将pH=4醋酸和pH=4氢氟酸混合,则HF的电离程度___________ (填“增大”、“减小”或“不变”)。
(2)将2mol/LCH3COONa溶液与1mol/L盐酸等体积混合,该溶液中各离子浓度由大到小顺序为___________ 。
(3)(NH4)2CO3溶液显___________ 性(填“中”、“酸”或“碱”),写出(NH4)2CO3溶液的质子守恒表达式___________ 。
(4)向TiCl4中加大量水同时加热可制备TiO2·xH2O,写出该反应的化学方程式___________ 。
(5)已知100℃时,0.01 mol/L的NaHSO4溶液中水电离的c(H+)=10-10mol/L,该温度下将pH=5的NaHSO4溶液V1L与pH=8的Ba(OH)2溶液V2L混合,所得溶液pH=7,则V1:V2为___________ (忽略溶液混合时的体积变化)。
| 化学式 | CH3COOH | H2CO3 | HF | NH3·H2O |
| 电离常数 | 1.8×10-5 | Ka1:4.5×10-7、Ka2:4.7×10-11 | 6.3×10-4 | 1.8×10-5 |
(2)将2mol/LCH3COONa溶液与1mol/L盐酸等体积混合,该溶液中各离子浓度由大到小顺序为
(3)(NH4)2CO3溶液显
(4)向TiCl4中加大量水同时加热可制备TiO2·xH2O,写出该反应的化学方程式
(5)已知100℃时,0.01 mol/L的NaHSO4溶液中水电离的c(H+)=10-10mol/L,该温度下将pH=5的NaHSO4溶液V1L与pH=8的Ba(OH)2溶液V2L混合,所得溶液pH=7,则V1:V2为
您最近一年使用:0次
4 . 铜盐是五颜六色的。某学习小组发现固体 (白色)、固体
(白色)、固体 (棕黄色)、固体
(棕黄色)、固体 (深褐色)。
(深褐色)。 和
和 溶液呈蓝色,
溶液呈蓝色, 溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
【查阅资料】
1.固体铜盐的颜色与阴离子极化能力有关,随化学键共价性增强,吸收光的能量下降,因此颜色加深。
2.在 溶液中存在如下平衡:
溶液中存在如下平衡:

【提出假设】
1.铜盐的颜色不同与离子种类有关。
2. 溶液呈绿色的原因是溶液中既有黄色的
溶液呈绿色的原因是溶液中既有黄色的 ,又有蓝色的
,又有蓝色的 ,根据光学原理蓝色和黄色的混合色为绿色。
,根据光学原理蓝色和黄色的混合色为绿色。
【设计方案】
回答下列问题:
(1)解释 的颜色深于
的颜色深于 的原因
的原因___________ 。
(2)配制 溶液的方法是
溶液的方法是___________ 。
(3)根据表中信息,补充试剂和数据:饱和___________ 、a=___________ 。
(4)实验4和5中溶液颜色差异的原因___________ (用平衡移动原理解释)。
(5)以上实验说明影响 溶液颜色的因素主要有
溶液颜色的因素主要有___________ 。(答两点即可)
【实验结论】假设1,2成立。
(6) 溶液呈现不同颜色的根本原因与
溶液呈现不同颜色的根本原因与 、
、 和
和___________ 微粒(写结构式)的浓度有关。
 (白色)、固体
(白色)、固体 (棕黄色)、固体
(棕黄色)、固体 (深褐色)。
(深褐色)。 和
和 溶液呈蓝色,
溶液呈蓝色, 溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。【查阅资料】
1.固体铜盐的颜色与阴离子极化能力有关,随化学键共价性增强,吸收光的能量下降,因此颜色加深。
2.在
 溶液中存在如下平衡:
溶液中存在如下平衡:
【提出假设】
1.铜盐的颜色不同与离子种类有关。
2.
 溶液呈绿色的原因是溶液中既有黄色的
溶液呈绿色的原因是溶液中既有黄色的 ,又有蓝色的
,又有蓝色的 ,根据光学原理蓝色和黄色的混合色为绿色。
,根据光学原理蓝色和黄色的混合色为绿色。【设计方案】
| 序号 | 温度/℃ | V( 氯化铜)/mL 氯化铜)/mL | V(饱和硫酸铜)/mL | V(饱和___________)/mL | V(饱和氯化钠)/mL | V(水)/mL | 溶液颜色 |
| 1 | 25 | 4.0 | 无色 | ||||
| 2 | 25 | 4.0 | 无色 | ||||
| 3 | 25 | 4.0 | 蓝色 | ||||
| 4 | 25 | 4.0 | 绿色 | ||||
| 5 | 25 | 2.0 | a | 蓝绿色 | |||
| 6 | 25 | 2.0 | 2.0 | 蓝绿色 | |||
| 7 | 25 | 2.0 | 2.0 | 黄绿色 | |||
| 8 | 50 | 4.0 | 黄绿色 |
(1)解释
 的颜色深于
的颜色深于 的原因
的原因(2)配制
 溶液的方法是
溶液的方法是(3)根据表中信息,补充试剂和数据:饱和
(4)实验4和5中溶液颜色差异的原因
(5)以上实验说明影响
 溶液颜色的因素主要有
溶液颜色的因素主要有【实验结论】假设1,2成立。
(6)
 溶液呈现不同颜色的根本原因与
溶液呈现不同颜色的根本原因与 、
、 和
和
您最近一年使用:0次
2024-01-13更新
|
656次组卷
|
4卷引用:辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题
名校
5 . 完成下列问题
(一)已知:25℃时,CH3COOH和NH3•H2O的电离常数相等。
(1)25℃时,取10mL0.1mol/L醋酸溶液测得其pH=3。25℃时,0.1mol/L氨水(NH3⋅H2O溶液)的pH=_______ ;
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液。
①当溶液的pH=7时,此时由水电离出来的氢离子的物质的量浓度_______ 10﹣7mol/L(填“>”、“=”或“<”)。
②在滴加过程中c(NH )/c(NH3⋅H2O)
)/c(NH3⋅H2O) _______ (填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(二)在常温下,下列五种溶液:
①0.1mol•L﹣1NH4Cl
②0.1mol•L﹣1CH3COONH4
③0.1mol•L﹣1NH4HSO4
④1L含0.1molNH3•H2O和0.1molNH4Cl混合液
⑤0.1mol•L﹣1NH3•H2O
(3)pH由小到大的顺序为_______ (填序号)。
(三)CO2是一种廉价的碳资源,其综合利用具有重要意义。
(4)新型Na﹣CO2电池工作原理为:4Na+3CO2 2Na2CO3+C,原电池以熔融的Na2CO3为电解质,放电时正极的电极反应为
2Na2CO3+C,原电池以熔融的Na2CO3为电解质,放电时正极的电极反应为 _______ 。
(5)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×10﹣9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为5.6×10﹣5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(一)已知:25℃时,CH3COOH和NH3•H2O的电离常数相等。
(1)25℃时,取10mL0.1mol/L醋酸溶液测得其pH=3。25℃时,0.1mol/L氨水(NH3⋅H2O溶液)的pH=
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液。
①当溶液的pH=7时,此时由水电离出来的氢离子的物质的量浓度
②在滴加过程中c(NH
 )/c(NH3⋅H2O)
)/c(NH3⋅H2O) a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(二)在常温下,下列五种溶液:
①0.1mol•L﹣1NH4Cl
②0.1mol•L﹣1CH3COONH4
③0.1mol•L﹣1NH4HSO4
④1L含0.1molNH3•H2O和0.1molNH4Cl混合液
⑤0.1mol•L﹣1NH3•H2O
(3)pH由小到大的顺序为
(三)CO2是一种廉价的碳资源,其综合利用具有重要意义。
(4)新型Na﹣CO2电池工作原理为:4Na+3CO2
 2Na2CO3+C,原电池以熔融的Na2CO3为电解质,放电时正极的电极反应为
2Na2CO3+C,原电池以熔融的Na2CO3为电解质,放电时正极的电极反应为 (5)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×10﹣9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为5.6×10﹣5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
名校
6 . 我们的日常生产、生活与化学有着紧密的联系。
Ⅰ.已知次磷酸( )是一元中强酸,请回答:
)是一元中强酸,请回答:
(1)写出其正盐在水溶液中水解的离子方程式:__________ 。
Ⅱ.现有常温下 的盐酸溶液和
的盐酸溶液和 的醋酸溶液,请根据下列操作回答问题:
的醋酸溶液,请根据下列操作回答问题:
(2)①常温下, 溶液加水稀释,下列数值增大的是
溶液加水稀释,下列数值增大的是__________ (填字母)。
A. B.
B. C.
C. D.
D.
②取10mL醋酸溶液,加入少量无水 固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将__________ (填“增大”“减小”或“不变”)。
③相同条件下,取等体积的盐酸溶液和醋酸溶液,分别与0.1mol/LNaOH溶液恰好反应,消耗NaOH溶液的体积
__________ (填“>”“<”或“=”)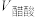 。
。
(3)某温度下,测得 的HCl溶液中,水电离出的氢离子的浓度
的HCl溶液中,水电离出的氢离子的浓度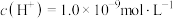 ,此温度下,将
,此温度下,将 盐酸溶液和
盐酸溶液和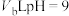 的
的 溶液混合均匀,测得溶液的
溶液混合均匀,测得溶液的 ,则
,则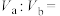
__________ 。(忽略混合后溶液体积变化)
Ⅲ.25℃时,有浓度均为0.10mol/L的下列4种溶液及几种酸的电离平衡常数:
①NaCN溶液②NaOH溶液③ 溶液④
溶液④ 溶液
溶液
(4)这4种溶液的pH由大到小的顺序是__________ (填序号)。
(5)向NaCN溶液中通入少量 ,则发生反应的离子方程式为
,则发生反应的离子方程式为__________ 。
(6)测得HCN和NaCN的混合溶液的 ,则
,则 约为
约为__________ (保留1位有效数字)。
(7) 和
和 混合溶液中,若溶液
混合溶液中,若溶液 ,则溶液中
,则溶液中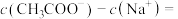
__________ (填精确值)mol/L。
Ⅰ.已知次磷酸(
 )是一元中强酸,请回答:
)是一元中强酸,请回答:(1)写出其正盐在水溶液中水解的离子方程式:
Ⅱ.现有常温下
 的盐酸溶液和
的盐酸溶液和 的醋酸溶液,请根据下列操作回答问题:
的醋酸溶液,请根据下列操作回答问题:(2)①常温下,
 溶液加水稀释,下列数值增大的是
溶液加水稀释,下列数值增大的是A.
 B.
B. C.
C. D.
D.
②取10mL醋酸溶液,加入少量无水
 固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将③相同条件下,取等体积的盐酸溶液和醋酸溶液,分别与0.1mol/LNaOH溶液恰好反应,消耗NaOH溶液的体积
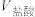
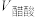 。
。(3)某温度下,测得
 的HCl溶液中,水电离出的氢离子的浓度
的HCl溶液中,水电离出的氢离子的浓度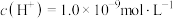 ,此温度下,将
,此温度下,将 盐酸溶液和
盐酸溶液和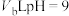 的
的 溶液混合均匀,测得溶液的
溶液混合均匀,测得溶液的 ,则
,则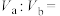
Ⅲ.25℃时,有浓度均为0.10mol/L的下列4种溶液及几种酸的电离平衡常数:
①NaCN溶液②NaOH溶液③
 溶液④
溶液④ 溶液
溶液HCN |
|
|
|
|
|
(5)向NaCN溶液中通入少量
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为(6)测得HCN和NaCN的混合溶液的
 ,则
,则 约为
约为(7)
 和
和 混合溶液中,若溶液
混合溶液中,若溶液 ,则溶液中
,则溶液中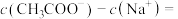
您最近一年使用:0次
解题方法
7 . 硫酸铵焙烧浸出液水解制备偏钛酸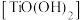 可回收钛。
可回收钛。
已知:i.一定条件下, 水解方程式:
水解方程式: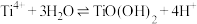
ii.一定温度下: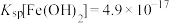
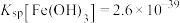
水解制备偏钛酸:浸出液中含 、
、 等,先向其中加入还原铁粉,然后控制水解条件实现
等,先向其中加入还原铁粉,然后控制水解条件实现 水解制备偏钛酸。
水解制备偏钛酸。
(1)用化学用语表示 溶液是酸性的原因
溶液是酸性的原因___________ 。
(2)浸出液(pH=2)时:① 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为___________ 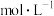 ;
; 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为___________  。
。
②若杂质离子沉淀会降低钛水解率。从定量角度解释加入还原铁粉的目的___________ 。
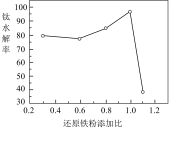
(3)一定条件下,还原铁粉添加比对钛水解率的影响如图所示。当还原铁粉添加比大于1时,钛水解率急剧下降。解释其原因___________ 。
已知: :
: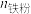 为还原铁粉添加量,
为还原铁粉添加量,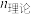 为浸出液中
为浸出液中 全部还原为
全部还原为 所需的还原铁粉理论量。
所需的还原铁粉理论量。
(4)一定条件下,温度对钛水解率的影响如图所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因___________ 。

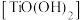 可回收钛。
可回收钛。已知:i.一定条件下,
 水解方程式:
水解方程式: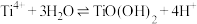
ii.一定温度下:
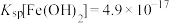
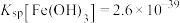
水解制备偏钛酸:浸出液中含
 、
、 等,先向其中加入还原铁粉,然后控制水解条件实现
等,先向其中加入还原铁粉,然后控制水解条件实现 水解制备偏钛酸。
水解制备偏钛酸。(1)用化学用语表示
 溶液是酸性的原因
溶液是酸性的原因(2)浸出液(pH=2)时:①
 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为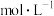 ;
; 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为 。
。②若杂质离子沉淀会降低钛水解率。从定量角度解释加入还原铁粉的目的
(3)一定条件下,还原铁粉添加比对钛水解率的影响如图所示。当还原铁粉添加比大于1时,钛水解率急剧下降。解释其原因

已知:
 :
: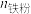 为还原铁粉添加量,
为还原铁粉添加量,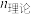 为浸出液中
为浸出液中 全部还原为
全部还原为 所需的还原铁粉理论量。
所需的还原铁粉理论量。(4)一定条件下,温度对钛水解率的影响如图所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因

您最近一年使用:0次
8 . 二氧化硫的治理已成为当前研究的课题。请回答下列问题:
(1)硫与硫的氧化物在转化过程中的能量变化如图所示。

①图中的Ⅰ、Ⅱ、Ⅲ、Ⅳ中属于放热反应的是___________ 。
(2)工业用 和
和 反应合成
反应合成 反应的反应热
反应的反应热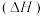 、活化能(
、活化能(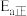 )为:
)为: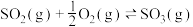
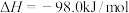
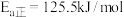 ,三氧化硫的分解反应
,三氧化硫的分解反应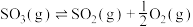 的活化能
的活化能
___________ kJ/mol。
(3)查阅资料可知,25℃,部分弱酸的电离平衡常数如表:
①0.1mol/L 溶液的pH
溶液的pH___________ (填“大于”“小于”或“等于”)0.1mol/L 溶液的pH。
溶液的pH。
②向 溶液通入少量
溶液通入少量 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4) 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放。
的排放。
方法1:电化学法处理
利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示。
污染,设计装置如图所示。
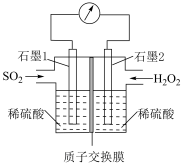
①石墨1电极处发生的电极反应式为___________ 。
方法2:用氨水除去
②已知25℃, 的
的 。若氨水的浓度为2.0mo/L,溶液中的
。若氨水的浓度为2.0mo/L,溶液中的 =
=___________ mol/L。将 通入该氨水中,当
通入该氨水中,当 降至
降至 时,结合(2)表中数据,计算溶液中的
时,结合(2)表中数据,计算溶液中的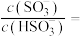
___________ 。
(1)硫与硫的氧化物在转化过程中的能量变化如图所示。

①图中的Ⅰ、Ⅱ、Ⅲ、Ⅳ中属于放热反应的是
(2)工业用
 和
和 反应合成
反应合成 反应的反应热
反应的反应热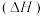 、活化能(
、活化能(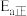 )为:
)为: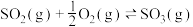
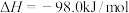
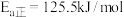 ,三氧化硫的分解反应
,三氧化硫的分解反应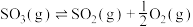 的活化能
的活化能
(3)查阅资料可知,25℃,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |
| 电离平衡常数(25℃) | 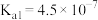 , ,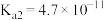 |  , ,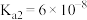 |
 溶液的pH
溶液的pH 溶液的pH。
溶液的pH。②向
 溶液通入少量
溶液通入少量 发生反应的离子方程式为
发生反应的离子方程式为(4)
 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放。
的排放。方法1:电化学法处理

利用过氧化氢吸收
 可消除
可消除 污染,设计装置如图所示。
污染,设计装置如图所示。
①石墨1电极处发生的电极反应式为
方法2:用氨水除去

②已知25℃,
 的
的 。若氨水的浓度为2.0mo/L,溶液中的
。若氨水的浓度为2.0mo/L,溶液中的 =
= 通入该氨水中,当
通入该氨水中,当 降至
降至 时,结合(2)表中数据,计算溶液中的
时,结合(2)表中数据,计算溶液中的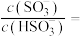
您最近一年使用:0次
2023-11-30更新
|
292次组卷
|
2卷引用:辽宁省沈阳市第二中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
9 . 已知常温下某二元弱酸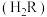 电离常数为
电离常数为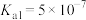 ,
, ,
, 电离常数为
电离常数为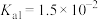 ,
,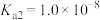 ,
, 的
的 ,HF的
,HF的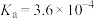 ,回答下列问题:
,回答下列问题:
(1)常温下向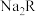 溶液加入少量的
溶液加入少量的 气体发生反应的离子方程式为
气体发生反应的离子方程式为___________
(2)常温下 的HF溶液浓度为c1,
的HF溶液浓度为c1, 的HF溶液浓度为c2,则c1
的HF溶液浓度为c2,则c1___________ 10c2(“>”、“<”或“=”)
(3)常温下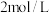 的
的 溶液的pH约为
溶液的pH约为___________ ;等浓度的 和
和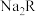 溶液中
溶液中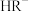 离子浓度的大小关系为前者
离子浓度的大小关系为前者___________ 后者(填“>”、“<”或“=”)。
(4)常温下 的NaHR溶液pOH
的NaHR溶液pOH___________ 7(填“>”、“<”或“=”)
(5)等浓度等体积的NaClO和NaF溶液中离子总数的大小关系为前者___________ 后者(填“>”、“<”或“=”)。
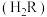 电离常数为
电离常数为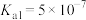 ,
, ,
, 电离常数为
电离常数为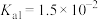 ,
,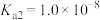 ,
, 的
的 ,HF的
,HF的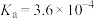 ,回答下列问题:
,回答下列问题:(1)常温下向
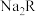 溶液加入少量的
溶液加入少量的 气体发生反应的离子方程式为
气体发生反应的离子方程式为(2)常温下
 的HF溶液浓度为c1,
的HF溶液浓度为c1, 的HF溶液浓度为c2,则c1
的HF溶液浓度为c2,则c1(3)常温下
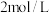 的
的 溶液的pH约为
溶液的pH约为 和
和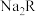 溶液中
溶液中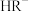 离子浓度的大小关系为前者
离子浓度的大小关系为前者(4)常温下
 的NaHR溶液pOH
的NaHR溶液pOH(5)等浓度等体积的NaClO和NaF溶液中离子总数的大小关系为前者
您最近一年使用:0次
名校
解题方法
10 .  是主要的大气污染物,某实验小组在室温下,通过实验研究工业废气脱除
是主要的大气污染物,某实验小组在室温下,通过实验研究工业废气脱除 的方法。可能用到的数据如下表:
的方法。可能用到的数据如下表:
(1) 溶液吸收法
溶液吸收法
当 和
和 以等物质的量进行混合,所得溶液呈
以等物质的量进行混合,所得溶液呈___________ 性,通过简单计算加以说明___________ ;
(2) 溶液吸收法
溶液吸收法
 在被
在被 溶液吸收时,可能发生的反应是
溶液吸收时,可能发生的反应是___________ (填代号);
a. b.
b.
c. d.
d.
(3)用 溶液吸收
溶液吸收
① 和吸收液反应方程式为
和吸收液反应方程式为___________ ;
②若将 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后
溶液等体积混合,混合后
___________ (填“增大”“减小”“不变”);
(4)用氨水吸收
已知溶液中 、
、 、
、 所占的物质的量分数(
所占的物质的量分数( )随
)随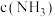 的变化曲线如图。
的变化曲线如图。

①求a点
___________ ;
②若b点 则
则
___________ ;
(5)电化学吸收法

a极为直流电源的___________ 极,与其相连的电极发生___________ 反应;
 是主要的大气污染物,某实验小组在室温下,通过实验研究工业废气脱除
是主要的大气污染物,某实验小组在室温下,通过实验研究工业废气脱除 的方法。可能用到的数据如下表:
的方法。可能用到的数据如下表:| 25℃ |  |  |  |
 |  |  | 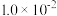 |
 |  |  |  |
(1)
 溶液吸收法
溶液吸收法当
 和
和 以等物质的量进行混合,所得溶液呈
以等物质的量进行混合,所得溶液呈(2)
 溶液吸收法
溶液吸收法 在被
在被 溶液吸收时,可能发生的反应是
溶液吸收时,可能发生的反应是a.
 b.
b.
c.
 d.
d.
(3)用
 溶液吸收
溶液吸收①
 和吸收液反应方程式为
和吸收液反应方程式为②若将
 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后
溶液等体积混合,混合后
(4)用氨水吸收
已知溶液中
 、
、 、
、 所占的物质的量分数(
所占的物质的量分数( )随
)随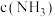 的变化曲线如图。
的变化曲线如图。
①求a点

②若b点
 则
则
(5)电化学吸收法

a极为直流电源的
您最近一年使用:0次