名校
解题方法
1 . 钢铁表面发黑(在钢铁表面形成一层致密的氧化物膜)可提高其耐磨、耐腐蚀性能。某实验小组欲利用下列装置进行发黑实验,并探究氧化物成分。
(1)实验开始前需将铁粉依次放入热的碳酸钠溶液和饱和氯化铵溶液中进行处理,其目的分别是___________ 和___________ 。
(2)向圆底烧瓶中逐滴滴入 、
、 的混合溶液至过量,在140℃下处理15~90min。
的混合溶液至过量,在140℃下处理15~90min。
①盛装混合溶液的仪器为___________ 。
②下列加热方法中,最合适的为___________ (填标号)。
A.水浴 B.油浴 C.酒精灯
(3)用乙装置收集产生的气体,请在装置中补全仪器。___________
(4)试剂X可以为___________ 。
(5)探究甲装置中固体产物(无铁单质剩余)成分。
取少量洗涤后的固体产物于试管中,滴入足量的稀硫酸,实验中固体全部溶解,无气体生成。将生成的溶液分成两份,分装于a、b两支试管中。
①向a试管中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明a试管中含有___________ (填离子符号)。
②不用硝酸溶解固体的原因为___________ 。
③向b试管中滴入___________ (填化学式)溶液,溶液变为血红色,说明b试管中含有___________ (填离子符号)。
(6)根据以上信息,推测圆底烧瓶中进行发黑实验时可能发生反应的化学方程式:___________ 。
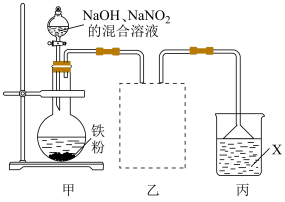
(1)实验开始前需将铁粉依次放入热的碳酸钠溶液和饱和氯化铵溶液中进行处理,其目的分别是
(2)向圆底烧瓶中逐滴滴入
 、
、 的混合溶液至过量,在140℃下处理15~90min。
的混合溶液至过量,在140℃下处理15~90min。①盛装混合溶液的仪器为
②下列加热方法中,最合适的为
A.水浴 B.油浴 C.酒精灯
(3)用乙装置收集产生的气体,请在装置中补全仪器。
(4)试剂X可以为
(5)探究甲装置中固体产物(无铁单质剩余)成分。
取少量洗涤后的固体产物于试管中,滴入足量的稀硫酸,实验中固体全部溶解,无气体生成。将生成的溶液分成两份,分装于a、b两支试管中。
①向a试管中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明a试管中含有
②不用硝酸溶解固体的原因为
③向b试管中滴入
(6)根据以上信息,推测圆底烧瓶中进行发黑实验时可能发生反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
379次组卷
|
4卷引用:河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题
名校
2 . 磷酸铁是锂离子电池常用正极材料,以硫铁矿( ,少量杂质
,少量杂质 ,
, )为原料制备磷酸铁的工艺流程图如下:
)为原料制备磷酸铁的工艺流程图如下:

回答下面问题:
(1)焙烧时发生的反应: ,在
,在 中S元素的化合价是
中S元素的化合价是_______ 价,该反应中氧化产物是_______ (填化学式)。
(2)加入Fe粉前浸取液中含量最多的金属阳离子是_______ ,其水解的离子方程式是_______ 。该离子与 溶液反应会生成红褐色沉淀,反应的离子方程式是
溶液反应会生成红褐色沉淀,反应的离子方程式是_______ 。
(3)滤渣B主要成分是 ,利用平衡移动原理解释加入
,利用平衡移动原理解释加入 固体除去
固体除去 的原理是:
的原理是:_______ (用离子方程式结合文字说明)。已知 ,完全沉淀时
,完全沉淀时 ,则“调pH”时溶液的pH最小是
,则“调pH”时溶液的pH最小是_______ 。
(4)已知 溶液呈碱性,写出
溶液呈碱性,写出 水解的水解常数表达式
水解的水解常数表达式
_______ 。比较 水解的水解常数
水解的水解常数 和
和 的电离常数
的电离常数 的大小:
的大小:
_______ (填“<”“>”或“=”) ,溶液中
,溶液中
_______ (填“<”“>”或“=”) 。
。
(5)在“沉淀”步骤中先加 目的是将
目的是将 氧化为
氧化为 ,写出反应的离子方程式
,写出反应的离子方程式_______ 。
 ,少量杂质
,少量杂质 ,
, )为原料制备磷酸铁的工艺流程图如下:
)为原料制备磷酸铁的工艺流程图如下:
回答下面问题:
(1)焙烧时发生的反应:
 ,在
,在 中S元素的化合价是
中S元素的化合价是(2)加入Fe粉前浸取液中含量最多的金属阳离子是
 溶液反应会生成红褐色沉淀,反应的离子方程式是
溶液反应会生成红褐色沉淀,反应的离子方程式是(3)滤渣B主要成分是
 ,利用平衡移动原理解释加入
,利用平衡移动原理解释加入 固体除去
固体除去 的原理是:
的原理是: ,完全沉淀时
,完全沉淀时 ,则“调pH”时溶液的pH最小是
,则“调pH”时溶液的pH最小是(4)已知
 溶液呈碱性,写出
溶液呈碱性,写出 水解的水解常数表达式
水解的水解常数表达式
 水解的水解常数
水解的水解常数 和
和 的电离常数
的电离常数 的大小:
的大小:
 ,溶液中
,溶液中
 。
。(5)在“沉淀”步骤中先加
 目的是将
目的是将 氧化为
氧化为 ,写出反应的离子方程式
,写出反应的离子方程式
您最近一年使用:0次
名校
3 . 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液;②NaClO溶液;③ 溶液,其pH由大到小的顺序是
溶液,其pH由大到小的顺序是___________ (填序号)。
(2)浓度均为0.1 mol/L① ;②
;② ;③
;③ ;④氨水;⑤
;④氨水;⑤ 五种溶液中,
五种溶液中, 由大到小的顺序
由大到小的顺序___________ (填序号)。
(3)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完后溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离平衡常数
的电离平衡常数
___________ 。
(4)泡沫灭火器中盛有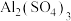 、
、 两种溶液,当它们混合时,发生反应的离子方程式为
两种溶液,当它们混合时,发生反应的离子方程式为___________ 。
(5)室温下, 的NaOH溶液和
的NaOH溶液和 的
的 溶液,设由水电离产生的
溶液,设由水电离产生的 的物质的量浓度分别为A和B,则
的物质的量浓度分别为A和B,则 等于
等于___________ 。
(6)亚磷酸溶液中的 H3PO3、H2PO 、HPO
、HPO 的物质的量分数δ(x)随 c(H+)的变化如图所示。
的物质的量分数δ(x)随 c(H+)的变化如图所示。
已知: 。
。

图像中c点c(H3PO3)=c(HPO ),那c点对应的c(H+)=
),那c点对应的c(H+)=___________ mol/L(只列出计算式)。
(7)25℃时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为___________ 。
| 化学式 | HF | HClO |  |  | H3PO3 |
| 电离常数 | 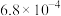 | 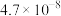 | 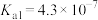 ; ; |  | Ka1=5.0×10-2Ka2=2.6×10-7 |
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液;②NaClO溶液;③
 溶液,其pH由大到小的顺序是
溶液,其pH由大到小的顺序是(2)浓度均为0.1 mol/L①
 ;②
;② ;③
;③ ;④氨水;⑤
;④氨水;⑤ 五种溶液中,
五种溶液中, 由大到小的顺序
由大到小的顺序(3)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完后溶液中
 ,用含a的代数式表示
,用含a的代数式表示 的电离平衡常数
的电离平衡常数
(4)泡沫灭火器中盛有
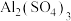 、
、 两种溶液,当它们混合时,发生反应的离子方程式为
两种溶液,当它们混合时,发生反应的离子方程式为(5)室温下,
 的NaOH溶液和
的NaOH溶液和 的
的 溶液,设由水电离产生的
溶液,设由水电离产生的 的物质的量浓度分别为A和B,则
的物质的量浓度分别为A和B,则 等于
等于(6)亚磷酸溶液中的 H3PO3、H2PO
 、HPO
、HPO 的物质的量分数δ(x)随 c(H+)的变化如图所示。
的物质的量分数δ(x)随 c(H+)的变化如图所示。已知:
 。
。
图像中c点c(H3PO3)=c(HPO
 ),那c点对应的c(H+)=
),那c点对应的c(H+)=(7)25℃时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为
您最近一年使用:0次
名校
4 . 食醋的主要酸性物质是醋酸,此外还含有少量其他弱酸,如乳酸等。实验室中用已知浓度的 溶液测定食醋的总酸度(以
溶液测定食醋的总酸度(以 计,单位
计,单位 ),实验步骤如下:
),实验步骤如下:
I. 标准溶液的配制与标定
标准溶液的配制与标定
用托盘天平称取mg 固体,配成500
固体,配成500 0.1
0.1
 溶液,并用邻苯二甲酸氢钾(
溶液,并用邻苯二甲酸氢钾(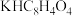 )进行标定,测得
)进行标定,测得 标准溶液的准确浓度为c
标准溶液的准确浓度为c 。
。
II.食醋总酸度的测定
准确量取25.00 食醋于250
食醋于250 容量瓶中,用新煮沸并冷却的蒸馏水稀释至刻度,摇匀。量取
容量瓶中,用新煮沸并冷却的蒸馏水稀释至刻度,摇匀。量取
 上述稀释后的试液于250
上述稀释后的试液于250 锥形瓶中,加入2~3滴指示剂。用上述c
锥形瓶中,加入2~3滴指示剂。用上述c
 标准溶液滴定至终点。平行测定3次,平均消耗
标准溶液滴定至终点。平行测定3次,平均消耗 标准溶液
标准溶液
 。据此计算食醋总酸度。
。据此计算食醋总酸度。
请回答下列问题:
(1)m=___________ g。 固体不能直接配制标准溶液,使用前需标定的原因是
固体不能直接配制标准溶液,使用前需标定的原因是___________ 。
(2)醋酸与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ 。
(3)稀释食醋使用的蒸馏水需煮沸,目的是___________ 。
(4)滴定实验过程中,除酸式滴定管、烧杯、铁架台、滴定管夹外,还需要的仪器有_______ 。
(5)当 溶液与醋酸恰好完全反应时,溶液呈碱性,其主要原因是
溶液与醋酸恰好完全反应时,溶液呈碱性,其主要原因是___________ (用离子方程式表示)。则应选用___________ (填“酚酞”或“甲基橙”)作指示剂。
(6)该食醋的总酸度为___________  (用含c、
(用含c、 、
、 的代数式表示)。
的代数式表示)。
 溶液测定食醋的总酸度(以
溶液测定食醋的总酸度(以 计,单位
计,单位 ),实验步骤如下:
),实验步骤如下:I.
 标准溶液的配制与标定
标准溶液的配制与标定用托盘天平称取mg
 固体,配成500
固体,配成500 0.1
0.1
 溶液,并用邻苯二甲酸氢钾(
溶液,并用邻苯二甲酸氢钾(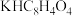 )进行标定,测得
)进行标定,测得 标准溶液的准确浓度为c
标准溶液的准确浓度为c 。
。II.食醋总酸度的测定
准确量取25.00
 食醋于250
食醋于250 容量瓶中,用新煮沸并冷却的蒸馏水稀释至刻度,摇匀。量取
容量瓶中,用新煮沸并冷却的蒸馏水稀释至刻度,摇匀。量取
 上述稀释后的试液于250
上述稀释后的试液于250 锥形瓶中,加入2~3滴指示剂。用上述c
锥形瓶中,加入2~3滴指示剂。用上述c
 标准溶液滴定至终点。平行测定3次,平均消耗
标准溶液滴定至终点。平行测定3次,平均消耗 标准溶液
标准溶液
 。据此计算食醋总酸度。
。据此计算食醋总酸度。请回答下列问题:
(1)m=
 固体不能直接配制标准溶液,使用前需标定的原因是
固体不能直接配制标准溶液,使用前需标定的原因是(2)醋酸与
 溶液反应的化学方程式为
溶液反应的化学方程式为(3)稀释食醋使用的蒸馏水需煮沸,目的是
(4)滴定实验过程中,除酸式滴定管、烧杯、铁架台、滴定管夹外,还需要的仪器有
(5)当
 溶液与醋酸恰好完全反应时,溶液呈碱性,其主要原因是
溶液与醋酸恰好完全反应时,溶液呈碱性,其主要原因是(6)该食醋的总酸度为
 (用含c、
(用含c、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
5 . 钛酸钡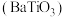 是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。以
是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。以 为原料制备
为原料制备 的工业流程如下:
的工业流程如下:

已知:①Ti元素在不同 条件下的存在形式:
条件下的存在形式:
② 可溶于水,
可溶于水, 微溶于水
微溶于水
③

回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ 。
(2)“焙烧”后固体产物为BaS,该步骤的化学方程式________ 。
(3)“净化”步骤加入过量 溶液的目的是
溶液的目的是_______ 。
(4)“除钙”步骤完成后溶液中 ,则
,则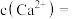
_______  。
。
(5) 溶液显
溶液显_______ 性(填“酸”、“碱”或“中”),“沉钛”步骤中不可用 溶液代替的原因是
溶液代替的原因是______ 。
(6)“沉钛”步骤生成 的化学方程式为
的化学方程式为________ 。
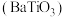 是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。以
是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。以 为原料制备
为原料制备 的工业流程如下:
的工业流程如下:
已知:①Ti元素在不同
 条件下的存在形式:
条件下的存在形式: |  |  |  |
| 存在形式 |  |  |  |
 可溶于水,
可溶于水, 微溶于水
微溶于水③


回答下列问题:
(1)
 在周期表中的位置为
在周期表中的位置为(2)“焙烧”后固体产物为BaS,该步骤的化学方程式
(3)“净化”步骤加入过量
 溶液的目的是
溶液的目的是(4)“除钙”步骤完成后溶液中
 ,则
,则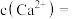
 。
。(5)
 溶液显
溶液显 溶液代替的原因是
溶液代替的原因是(6)“沉钛”步骤生成
 的化学方程式为
的化学方程式为
您最近一年使用:0次
6 . 医学上常用酸性 溶液和草酸溶液的反应来测定血钙的含量。测定方法如下:
溶液和草酸溶液的反应来测定血钙的含量。测定方法如下:
①将2.00mL血液用蒸馏水稀释至20.00mL后,向其中加入足量 溶液,反应生成
溶液,反应生成 沉淀,过滤后,将沉淀用足量稀硫酸处理得
沉淀,过滤后,将沉淀用足量稀硫酸处理得 溶液;
溶液;
②将①得到的 溶液装入锥形瓶内,再用
溶液装入锥形瓶内,再用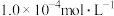 酸性
酸性 溶液滴定,达到终点时用去
溶液滴定,达到终点时用去 溶液的体积为10.00mL。
溶液的体积为10.00mL。
(1)酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
(2)滴定时,酸性 溶液可盛放在___________中。
溶液可盛放在___________中。
(3)判断滴定终点的颜色变化是___________ 。
(4)实验测得该血液中钙的含量为___________  。
。
(5)若滴定过程中,锥形瓶内液体外溅,将导致测定结果___________ 。
(6)已知:25℃时, 的
的 ,
, 的
的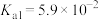 ,
,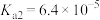 。
。 溶液中,
溶液中,
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
 溶液和草酸溶液的反应来测定血钙的含量。测定方法如下:
溶液和草酸溶液的反应来测定血钙的含量。测定方法如下:①将2.00mL血液用蒸馏水稀释至20.00mL后,向其中加入足量
 溶液,反应生成
溶液,反应生成 沉淀,过滤后,将沉淀用足量稀硫酸处理得
沉淀,过滤后,将沉淀用足量稀硫酸处理得 溶液;
溶液;②将①得到的
 溶液装入锥形瓶内,再用
溶液装入锥形瓶内,再用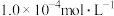 酸性
酸性 溶液滴定,达到终点时用去
溶液滴定,达到终点时用去 溶液的体积为10.00mL。
溶液的体积为10.00mL。(1)酸性
 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(2)滴定时,酸性
 溶液可盛放在___________中。
溶液可盛放在___________中。| A.酸式滴定管 | B.碱式滴定管 | C.聚四氟乙烯滴定管 | D.锥形瓶 |
(4)实验测得该血液中钙的含量为
 。
。(5)若滴定过程中,锥形瓶内液体外溅,将导致测定结果
(6)已知:25℃时,
 的
的 ,
, 的
的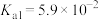 ,
,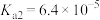 。
。 溶液中,
溶液中,
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
您最近一年使用:0次
7 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如下:
下列反应可以发生的是_______(填标号)。
(4)相同条件下,0.1 mol/LNH4Al(SO4)2溶液中的c( )
)____ 0.1 mol/LNH4HSO4溶液中的c( ) (填“>”“<"或“=”)。
) (填“>”“<"或“=”)。
(5)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似。盐酸肼(N2H6Cl2)属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第一 步水解反应的离子方程式为___________ 。
(6)常温下,往100 mL0.1 mol/L的H2R溶液(此时为a点)中不断加入NaOH固体(忽略溶液体积变化),溶液中由水电离出来的c水(H+)的负对数[−lgc水(H+)]与lg 的变化关系如图所示:
的变化关系如图所示:

①请写出H2R的主要电离方程式:___________ 。
②依据信息,图中d的坐标应为___________ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mLl mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如下:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
| A.CH3COOH+ Na2CO3=NaHCO3 +CH3COONa |
| B.CH3COOH+NaCN=CH3COONa+HCN |
| C.CO2+H2O+2NaClO=Na2CO3+2HClO |
| D.NaHCO3+HCN=NaCN+H2O+CO2↑ |
(4)相同条件下,0.1 mol/LNH4Al(SO4)2溶液中的c(
 )
) ) (填“>”“<"或“=”)。
) (填“>”“<"或“=”)。(5)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似。盐酸肼(N2H6Cl2)属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第一 步水解反应的离子方程式为
(6)常温下,往100 mL0.1 mol/L的H2R溶液(此时为a点)中不断加入NaOH固体(忽略溶液体积变化),溶液中由水电离出来的c水(H+)的负对数[−lgc水(H+)]与lg
 的变化关系如图所示:
的变化关系如图所示:
①请写出H2R的主要电离方程式:
②依据信息,图中d的坐标应为
您最近一年使用:0次
2024-02-02更新
|
163次组卷
|
2卷引用:河北省保定市唐县第一中学2023-2024学年高二上学期1月期末化学试题
名校
8 . I.常温下,向20mL 的MOH溶液中逐滴加入0.1mol/LHCl溶液,滴定曲线如图所示。请回答下列问题:
的MOH溶液中逐滴加入0.1mol/LHCl溶液,滴定曲线如图所示。请回答下列问题:

(1)常温下,该碱的电离平衡常数 =
=______ 。
(2)滴定到C点时,溶液中各离子浓度由大到小的顺序是______ 。
(3)图中A、B、C三点溶液中水的电离程度最大的是______ 。
Ⅱ.已知Na2A溶液中存在的粒子为Na+、HA﹣、A2﹣、H+、OH﹣、H2O,回答下列问题:
(4)NaHA溶液显______ (填“酸性”或“碱性”或“中性”),原因是______ (用离子方程式表示)
(5)NaHA溶液中有关粒子的浓度关系正确的是______
 的MOH溶液中逐滴加入0.1mol/LHCl溶液,滴定曲线如图所示。请回答下列问题:
的MOH溶液中逐滴加入0.1mol/LHCl溶液,滴定曲线如图所示。请回答下列问题:
(1)常温下,该碱的电离平衡常数
 =
=(2)滴定到C点时,溶液中各离子浓度由大到小的顺序是
(3)图中A、B、C三点溶液中水的电离程度最大的是
Ⅱ.已知Na2A溶液中存在的粒子为Na+、HA﹣、A2﹣、H+、OH﹣、H2O,回答下列问题:
(4)NaHA溶液显
(5)NaHA溶液中有关粒子的浓度关系正确的是______
A. | B. |
C. | D. |
您最近一年使用:0次
9 . 研究化学平衡是中学化学中非常重要的课题。请回答下列问题:
(1)已知: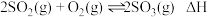 ,不同条件下反应进程的能量变化如图所示,则该反应在
,不同条件下反应进程的能量变化如图所示,则该反应在___________ (填“低温”或“高温”)下能自发进行。

(2)盐碱地(含较多 、
、 )不利于植物生长,盐碱地呈
)不利于植物生长,盐碱地呈___________ (填“酸”“碱”或“中”)性,用离子方程式说明呈该性的原因:___________ 。
(3) 时,
时, 的电离常数为
的电离常数为 ;
; 的电离常数为
的电离常数为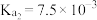 ,
,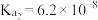 ,
,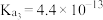 。在
。在 溶液加入过量
溶液加入过量 溶液的离子反应方程式为
溶液的离子反应方程式为___________ 。
(4)相同条件下,下列四种溶液中 由大到小的顺序是
由大到小的顺序是___________ (填序号)。
①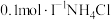 溶液
溶液
② 溶液
溶液
③ 溶液
溶液
④ 氨水
氨水
(5) 时,
时, 的盐酸和
的盐酸和 的
的 溶液中由水电离出的
溶液中由水电离出的 之比为
之比为___________ 。
(6)某温度时, ,
, ,
,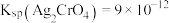 。某溶液中含有
。某溶液中含有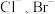 和
和 ,浓度均为
,浓度均为 ,向该溶液中逐滴加入
,向该溶液中逐滴加入 的
的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为___________ (用阴离子符号表示)。
(7)已知常温下次氯酸的电离平衡常数为 ,该温度下
,该温度下 次氯酸溶液的pH为
次氯酸溶液的pH为___________ 。
(1)已知:
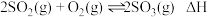 ,不同条件下反应进程的能量变化如图所示,则该反应在
,不同条件下反应进程的能量变化如图所示,则该反应在
(2)盐碱地(含较多
 、
、 )不利于植物生长,盐碱地呈
)不利于植物生长,盐碱地呈(3)
 时,
时, 的电离常数为
的电离常数为 ;
; 的电离常数为
的电离常数为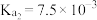 ,
,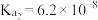 ,
,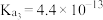 。在
。在 溶液加入过量
溶液加入过量 溶液的离子反应方程式为
溶液的离子反应方程式为(4)相同条件下,下列四种溶液中
 由大到小的顺序是
由大到小的顺序是①
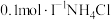 溶液
溶液②
 溶液
溶液③
 溶液
溶液④
 氨水
氨水(5)
 时,
时, 的盐酸和
的盐酸和 的
的 溶液中由水电离出的
溶液中由水电离出的 之比为
之比为(6)某温度时,
 ,
, ,
,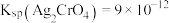 。某溶液中含有
。某溶液中含有 和
和 ,浓度均为
,浓度均为 ,向该溶液中逐滴加入
,向该溶液中逐滴加入 的
的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为(7)已知常温下次氯酸的电离平衡常数为
 ,该温度下
,该温度下 次氯酸溶液的pH为
次氯酸溶液的pH为
您最近一年使用:0次
解题方法
10 . 滴定法是重要的化学定量分析方法,包括酸碱滴定,氧化还原滴定,沉淀滴定等等,实验过程包括配制标准溶液和滴定待测溶液,现使用酸碱中和滴定法测定市售白醋的总酸量(总酸量单位:g/100mL)。回答下列问题:
(1)配制250mL0.1000mol•L-1NaOH标准溶液,下列仪器不需要的是______ (填字母)。
(2)准备与滴定:
①用蒸馏水洗涤碱式滴定管,注入0.1000mol•L-1标准NaOH溶液至“0”刻度线以上;
②固定好碱式滴定管并使碱式滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准碱液滴定至终点,记下碱式滴定管液面读数;
⑥重复以上滴定操作3次.
a.以上步骤有错误的为_______ 个。
b.排除碱式滴定管中气泡的方法应采用如图所示操作中的_______ (填序号)。

(3)步骤⑤中滴定时眼睛应注视_______ ,边滴边摇动锥形瓶(接近终点时,改为滴加半滴碱),直到因加入半滴碱后,溶液颜色从_______ ,表示已经到达滴定终点。
四次测定数据如表:
(4)数据处理与计算:
①计算得出白醋的总酸量为_______ g/100mL。
②实验测定白醋的总酸量比理论值偏大,可能的原因是_______ (填字母)。
A.在滴定过程中,摇晃锥形瓶时,不小心让锥形瓶内液体洒出去了一部分
B.用待测的白醋润洗锥形瓶,再装入一定体积的待测白醋进行滴定
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
D.使用酸式滴定管量取20.00mL待测液,读取体积时,滴定前平视读数,滴定后俯视读数
(5)曲线分析:
常温下,以NaOH溶液的体积为横坐标,pH为纵坐标得到的滴定曲线如图所示:
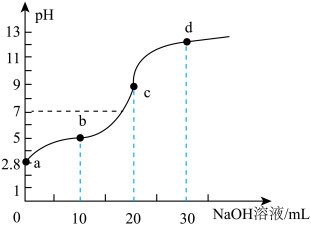
实验测得c点溶液的pH=9,则溶液中由水电离出来的c(OH—)=_______ mol•L-1。
(1)配制250mL0.1000mol•L-1NaOH标准溶液,下列仪器不需要的是
 |  |  |  |
| A | B | C | D |
①用蒸馏水洗涤碱式滴定管,注入0.1000mol•L-1标准NaOH溶液至“0”刻度线以上;
②固定好碱式滴定管并使碱式滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准碱液滴定至终点,记下碱式滴定管液面读数;
⑥重复以上滴定操作3次.
a.以上步骤有错误的为
b.排除碱式滴定管中气泡的方法应采用如图所示操作中的

(3)步骤⑤中滴定时眼睛应注视
四次测定数据如表:
| 序号 | 1 | 2 | 3 | 4 |
| 标准溶液体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
①计算得出白醋的总酸量为
②实验测定白醋的总酸量比理论值偏大,可能的原因是
A.在滴定过程中,摇晃锥形瓶时,不小心让锥形瓶内液体洒出去了一部分
B.用待测的白醋润洗锥形瓶,再装入一定体积的待测白醋进行滴定
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
D.使用酸式滴定管量取20.00mL待测液,读取体积时,滴定前平视读数,滴定后俯视读数
(5)曲线分析:
常温下,以NaOH溶液的体积为横坐标,pH为纵坐标得到的滴定曲线如图所示:

实验测得c点溶液的pH=9,则溶液中由水电离出来的c(OH—)=
您最近一年使用:0次



