1 . 完成下列问题
(1)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一,最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的反应是:___________ ;汽油燃料电池最大的障碍是氧化反应不完全产生___________ (填化学式)堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
(2)某温度下0.1mol/LNa2CO3溶液中,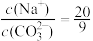 >2,其原因是(用离子方程式说明):
>2,其原因是(用离子方程式说明):_________ ,常温下,pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则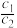 =
=___________ ;
(3)恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g) C(g);
C(g);
①若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为___________ mol;
②若开始时放入XmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是Ymol和3amol,则X=___________ ,Y=___________ 。
(1)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一,最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的反应是:
(2)某温度下0.1mol/LNa2CO3溶液中,
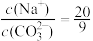 >2,其原因是(用离子方程式说明):
>2,其原因是(用离子方程式说明):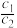 =
=(3)恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g)
 C(g);
C(g);①若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为
②若开始时放入XmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是Ymol和3amol,则X=
您最近一年使用:0次
名校
解题方法
2 . 某矿渣中含MgO、Al2O3,、Fe2O3,和SiO2等,通过下列工艺流程可回收其中的Mg、Fe、Al等。

已知:i.溶液中的目标离子浓度小于或等于10-5mol·L-1时,该离子已经完全沉淀。
ii.室温下部分金属离子转化为氢氧化物沉淀的相关pH如下表:
回答下列问题:
(1)“酸浸”时,可以提高浸取反应速率的措施有_______ (任写一条)。
(2)调 ①调整
①调整 合适的范围是
合适的范围是_______ ,若室温下调节 ,则溶液中
,则溶液中
_____  。
。
(3)“调 ②”的目的是
②”的目的是_______ ,“滤液”中溶质的主要成分是_______ (填化学式)。
(4) “加热”制备
“加热”制备 时,必须在
时,必须在 氛围中进行,其目的是
氛围中进行,其目的是_______ 。
(5)“电解”制金属 时:
时:
① 的状态为
的状态为____ (填标号)。
A.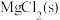 B.
B.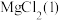 C.
C. (aq)
(aq)
②阳极的电极反应式为____ 。

已知:i.溶液中的目标离子浓度小于或等于10-5mol·L-1时,该离子已经完全沉淀。
ii.室温下部分金属离子转化为氢氧化物沉淀的相关pH如下表:
| 金属离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 |
| 沉淀完全的pH | 3.2 | 4.7 | 11.1 |
(1)“酸浸”时,可以提高浸取反应速率的措施有
(2)调
 ①调整
①调整 合适的范围是
合适的范围是 ,则溶液中
,则溶液中
 。
。(3)“调
 ②”的目的是
②”的目的是(4)
 “加热”制备
“加热”制备 时,必须在
时,必须在 氛围中进行,其目的是
氛围中进行,其目的是(5)“电解”制金属
 时:
时:①
 的状态为
的状态为A.
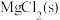 B.
B.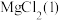 C.
C. (aq)
(aq)②阳极的电极反应式为
您最近一年使用:0次
2024-02-29更新
|
129次组卷
|
2卷引用:海南省部分学校2023-2024学年高二上学期1月期末联考化学试题
3 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/L 溶液的滴定曲线如图所示。
溶液的滴定曲线如图所示。
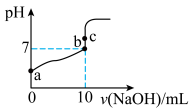
① 在水中的电离方程式为:
在水中的电离方程式为:___________ 。
②下列说法正确的是___________ 。
A.a点溶液的
B.b点溶液中: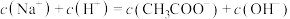
C.c点溶液中,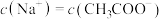
D.a、b、c三点中,c点时水的电离程度最大
(2)已知:25℃时CH3COOH、HClO、H2CO3和H3PO3的电离平衡常数:
①25℃时,浓度均为0.1mol/L的 溶液、NaClO溶液的碱性较大的是
溶液、NaClO溶液的碱性较大的是___________ 。
②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1mol/L,达到电离平衡时溶液中
___________ mol/L。
③下列化学反应可能发生的是___________ 。
A.
B.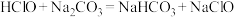
④亚磷酸( )为二元酸,具有较强的还原性
)为二元酸,具有较强的还原性 是
是_______ (填“酸式盐”、“碱式盐”或“正盐”)。
(1)常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/L
 溶液的滴定曲线如图所示。
溶液的滴定曲线如图所示。
①
 在水中的电离方程式为:
在水中的电离方程式为:②下列说法正确的是
A.a点溶液的

B.b点溶液中:
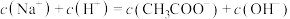
C.c点溶液中,
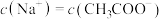
D.a、b、c三点中,c点时水的电离程度最大
(2)已知:25℃时CH3COOH、HClO、H2CO3和H3PO3的电离平衡常数:
| 化学式 |  | HClO |  |  |
| 名称 | 醋酸 | 次氯酸 | 碳酸 | 亚磷酸 |
| 电离平衡常数 |  |  | 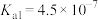  | 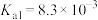 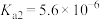 |
 溶液、NaClO溶液的碱性较大的是
溶液、NaClO溶液的碱性较大的是②25℃时,若初始时次氯酸溶液中HClO的物质的量浓度为0.1mol/L,达到电离平衡时溶液中

③下列化学反应可能发生的是
A.

B.
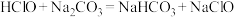
④亚磷酸(
 )为二元酸,具有较强的还原性
)为二元酸,具有较强的还原性 是
是
您最近一年使用:0次
解题方法
4 . 纳米级硒化铜( )是钠离子电池的正极材料。某小组以黄铜矿(主要含
)是钠离子电池的正极材料。某小组以黄铜矿(主要含 ,含少量
,含少量 、
、 杂质)为原料,在酸性条件下采用生物催化氧化法制备纳米级硒化铜的流程如图所示:
杂质)为原料,在酸性条件下采用生物催化氧化法制备纳米级硒化铜的流程如图所示:

请回答下列问题:
(1)滤渣的主要成分是___________ (填化学式)。深蓝色溶液中溶质的主要成分是___________ (填化学式)。
(2)“浸取”步骤中,其他条件相同时,测得金属浸出率与温度的关系如图所示。
 酸性溶液/细菌
酸性溶液/细菌
40℃时金属浸出率达到“峰值”的原因可能是___________ 。
(3)“浸取”步骤中,每浸取1mol 理论上消耗氧气的物质的量为
理论上消耗氧气的物质的量为___________ mol。
(4)用CuO或 替代氨水可以达到相同的目的,其可能原因是
替代氨水可以达到相同的目的,其可能原因是___________ 。
 )是钠离子电池的正极材料。某小组以黄铜矿(主要含
)是钠离子电池的正极材料。某小组以黄铜矿(主要含 ,含少量
,含少量 、
、 杂质)为原料,在酸性条件下采用生物催化氧化法制备纳米级硒化铜的流程如图所示:
杂质)为原料,在酸性条件下采用生物催化氧化法制备纳米级硒化铜的流程如图所示:
请回答下列问题:
(1)滤渣的主要成分是
(2)“浸取”步骤中,其他条件相同时,测得金属浸出率与温度的关系如图所示。
 酸性溶液/细菌
酸性溶液/细菌40℃时金属浸出率达到“峰值”的原因可能是
(3)“浸取”步骤中,每浸取1mol
 理论上消耗氧气的物质的量为
理论上消耗氧气的物质的量为(4)用CuO或
 替代氨水可以达到相同的目的,其可能原因是
替代氨水可以达到相同的目的,其可能原因是
您最近一年使用:0次
名校
5 . 钒(V)是一种重要的金属,有金属“维生素”之称,用途涵盖了航空航天、电池、光学、医药等众多领域,主要由五氧化二钒冶炼得到。某种由钒精矿(含 及少量MgO、
及少量MgO、 等杂质)提取五氧化二钒的工艺流程如下图所示。
等杂质)提取五氧化二钒的工艺流程如下图所示。

【资料】+5价钒在溶液中的主要存在形式与溶液pH的关系:
(1)钒精矿磨细的目的是_______ ,浸出液中含有钒酸钠(Na3VO4)。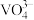 与
与 的空间构型相同,键角的大小为
的空间构型相同,键角的大小为_______ 。
(2)用硫酸缓慢调节浸出液的pH为7,得到净化液中主要的阴离子是_______ 。
(3)氨化沉钒:将净化液中的钒转化为 固体,其流程如下。
固体,其流程如下。

向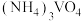 溶液中加入
溶液中加入 溶液的目的:
溶液的目的:_______ 。
(4)煅烧2.340g偏钒酸铵( ,摩尔质量为117g/mol)时,其固体质量的减少量随温度变化的曲线如图所示:
,摩尔质量为117g/mol)时,其固体质量的减少量随温度变化的曲线如图所示:

100~200℃时产生的一种气体的化学式为_______ ,300~350℃时发生反应的化学方程式为_______ 。
 及少量MgO、
及少量MgO、 等杂质)提取五氧化二钒的工艺流程如下图所示。
等杂质)提取五氧化二钒的工艺流程如下图所示。
【资料】+5价钒在溶液中的主要存在形式与溶液pH的关系:
| PH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | 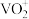 | 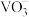 | 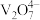 | 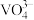 |
(1)钒精矿磨细的目的是
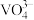 与
与 的空间构型相同,键角的大小为
的空间构型相同,键角的大小为(2)用硫酸缓慢调节浸出液的pH为7,得到净化液中主要的阴离子是
(3)氨化沉钒:将净化液中的钒转化为
 固体,其流程如下。
固体,其流程如下。
向
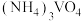 溶液中加入
溶液中加入 溶液的目的:
溶液的目的:(4)煅烧2.340g偏钒酸铵(
 ,摩尔质量为117g/mol)时,其固体质量的减少量随温度变化的曲线如图所示:
,摩尔质量为117g/mol)时,其固体质量的减少量随温度变化的曲线如图所示:
100~200℃时产生的一种气体的化学式为
您最近一年使用:0次
名校
6 . 水溶液中的离子反应和平衡状态与生活、生产及环境保护等息息相关。请回答下列问题:
(1)25℃时,
___________ ;
(2)已知25℃时,HCN的 ,则NaCN溶液显
,则NaCN溶液显___________ (填“酸性”、“中性”或“碱性”),结合离子反应方程式 分析其原因是___________ 。
(3)25℃时,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为___________ 。
(4)已知25℃时, 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
___________ ,溶液中各离子物质的量浓度由大到小的顺序为___________ 。
(5)25℃时, 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是___________ (填序号)。
(6)某同学用 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:

①NaOH溶液滴定 溶液的曲线是
溶液的曲线是___________ (填“图1”或“图2”)曲线。
②图1和图2中的a=___________ 。
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数 [
[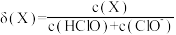 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为___________ 。

(1)25℃时,

(2)已知25℃时,HCN的
 ,则NaCN溶液显
,则NaCN溶液显(3)25℃时,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(4)已知25℃时,
 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
(5)25℃时,
 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是| 电解质 |  |  | HCN |  |
| 电离常数 | 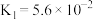  |  | 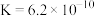 |  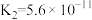 |
(6)某同学用
 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:
①NaOH溶液滴定
 溶液的曲线是
溶液的曲线是②图1和图2中的a=
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数
 [
[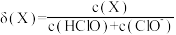 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为
您最近一年使用:0次
解题方法
7 . 铝鞣剂主要成分为Al(OH)2Cl,主要用于揉制皮革。利用铝灰(主要成分为Al、Al2O3、AlN,FeO等)制备铝鞣剂的一种工艺如图所示:

请回答下列问题:
(1)气体A、气体C的分子式为___________ 、___________ 。
(2)产生气体B的化学方程式为:___________ 。
(3)氧化时,发生反应的离子方程式为:___________ 。
(4)废渣的主要成分为___________ (填化学式)。
(5)某同学设计如下方案测定铝鞣剂样品中Al(OH)2Cl质量分数。
操作I:准确称取所制备的铝鞣剂mg放入烧杯中。
操作II:加入___________ (填试剂名称),并用玻璃棒搅拌至固体全部溶解。
操作III:加入足量_____ (填化学式)溶液,充分反应,_____ 、_______ 、干燥得固体ng。
根据所测数据即可计算出样品中Al(OH)2Cl质量分数为___________ 。

请回答下列问题:
(1)气体A、气体C的分子式为
(2)产生气体B的化学方程式为:
(3)氧化时,发生反应的离子方程式为:
(4)废渣的主要成分为
(5)某同学设计如下方案测定铝鞣剂样品中Al(OH)2Cl质量分数。
操作I:准确称取所制备的铝鞣剂mg放入烧杯中。
操作II:加入
操作III:加入足量
根据所测数据即可计算出样品中Al(OH)2Cl质量分数为
您最近一年使用:0次
解题方法
8 . 已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如表:
①写出上述反应的平衡常数表达式:__________ ,反应的ΔH__________ 0(填“>”或“<”)
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量__________ (填“增大”“减小”或“不变”,下同);充入氦气,混合气体的密度__________ 。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是__________ 。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是____ (填字母);将各溶液分别稀释100倍,pH变化最小的是____ (填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③生活中我们可以用醋酸除去热水瓶中的水垢(主要成分是CaCO3),请用离子方程式表示其原因:_____________ 。
(1)可逆反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
③生活中我们可以用醋酸除去热水瓶中的水垢(主要成分是CaCO3),请用离子方程式表示其原因:
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D、E是中学常见的五种化合物,它们之间有下列转化关系:
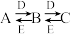
已知A溶液显碱性,焰色反应为黄色,且可促进水的电离。
(1)若A、B、C中含有相同的金属元素,且B为白色沉淀物,则A的化学式为____ ,D的化学式为_____ ;A、C反应生成B的离子方程式为___________ 。
(2)若C是一种无色无味的气体,用离子方程式表示A溶液显碱性的原因___________ ,C与E反应生成B的化学方程式为________ 。
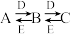
已知A溶液显碱性,焰色反应为黄色,且可促进水的电离。
(1)若A、B、C中含有相同的金属元素,且B为白色沉淀物,则A的化学式为
(2)若C是一种无色无味的气体,用离子方程式表示A溶液显碱性的原因
您最近一年使用:0次
名校
10 . 氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______ 。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______ ,通过实验数据,计算该产品的纯度为_______ (用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______ 。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
②滴定终点的现象是
③上表第一次实验中记录数据明显大于后两次,其原因可能是
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
您最近一年使用:0次
2020-03-12更新
|
151次组卷
|
2卷引用:海南省海口市海南中学2020届高三下学期第七次月考化学试题



