1 . 氢氧化铋 和铋酸钠
和铋酸钠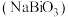 均为重要的含铋化合物。某学习小组在实验室对两种化合物的性质和制备等进行探究。两种化合物的相关信息如下表所示:
均为重要的含铋化合物。某学习小组在实验室对两种化合物的性质和制备等进行探究。两种化合物的相关信息如下表所示:
回答下列问题:
(1)由 溶液直接加热制备
溶液直接加热制备 时,常混有BiOCl杂质,其原因是
时,常混有BiOCl杂质,其原因是________ (用化学方程式表示)。
(2)实验室可用如图所示装置,由 制备
制备 。
。________ (填装置接口字母)。连接好装置后,先进行的操作是________ 。
②试剂X的名称为________ 。
③装置B中发生反应的离子方程式为________ 。
④实验结束拆除装置前,先关闭 ,后打开
,后打开 ,向装置A中加入一定量NaOH溶液,其目的是
,向装置A中加入一定量NaOH溶液,其目的是________ 。此时,可能观察到的现象为________ 。
(3)向酸性 溶液中加入
溶液中加入 ,溶液变为紫色,则氧化性:
,溶液变为紫色,则氧化性:
________ (填“>”或“<”)  。
。
 和铋酸钠
和铋酸钠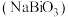 均为重要的含铋化合物。某学习小组在实验室对两种化合物的性质和制备等进行探究。两种化合物的相关信息如下表所示:
均为重要的含铋化合物。某学习小组在实验室对两种化合物的性质和制备等进行探究。两种化合物的相关信息如下表所示:物质 | 颜色 | 性质 |
| 白色 | 溶于酸,不溶于水、乙醇和碱溶液,受热易分解 |
| 浅黄色 | 不溶于水,在热水中水解 |
(1)由
 溶液直接加热制备
溶液直接加热制备 时,常混有BiOCl杂质,其原因是
时,常混有BiOCl杂质,其原因是(2)实验室可用如图所示装置,由
 制备
制备 。
。
②试剂X的名称为
③装置B中发生反应的离子方程式为
④实验结束拆除装置前,先关闭
 ,后打开
,后打开 ,向装置A中加入一定量NaOH溶液,其目的是
,向装置A中加入一定量NaOH溶液,其目的是(3)向酸性
 溶液中加入
溶液中加入 ,溶液变为紫色,则氧化性:
,溶液变为紫色,则氧化性:
 。
。
您最近一年使用:0次
2 . 已知 H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2∙2H2O),为制取纯净的CuCl2∙2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
(1)本实验最适合的氧化剂X是___________(填序号)。
(2)物质Y可以选择以下___________。
(3)本实验用加碱沉淀法能不能达到目的?___________ (填“能”或“不能”)。
(4)加氧化剂的目的是___________ 。
(5)最后蒸发结晶要想得到CuCl2∙2H2O晶体,应如何操作?___________ 。
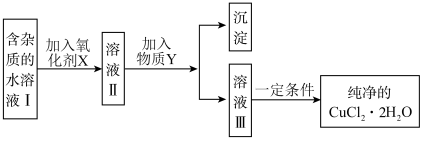
(1)本实验最适合的氧化剂X是___________(填序号)。
| A.K2Cr2O7 | B.NaClO | C. H2O2 | D.KMnO4 |
(2)物质Y可以选择以下___________。
| A.CuO | B.CuSO4 | C.Cu(OH)2 | D.KOH |
(3)本实验用加碱沉淀法能不能达到目的?
(4)加氧化剂的目的是
(5)最后蒸发结晶要想得到CuCl2∙2H2O晶体,应如何操作?
您最近一年使用:0次
解题方法
3 . 回答下列问题。
(1)在某温度下,向含有AgCl固体的AgCl饱和溶液中通入少量HCl,则AgCl的溶解度___________ (填“增大”“减小”或“不变”,下同),Ksp___________ ,c(Ag+)___________ 。
(2)在25℃时对氨水进行如下操作,若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH___________ 7(“大于”、“小于”或“等于”);若向氨水中加入稀硫酸至溶液的pH=7,此时溶液中 =amol/L,则
=amol/L,则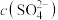 =
=___________ 。
(3)若要在铁制品表面镀镍,电镀液用硫酸镍溶液,则镍应与电源的___________ 极相连,铁制品应与电源的___________ 极相连。电镀过程中硫酸镍溶液中溶质的浓度会___________ (填“增大”“减小”或“不变”)。
(1)在某温度下,向含有AgCl固体的AgCl饱和溶液中通入少量HCl,则AgCl的溶解度
(2)在25℃时对氨水进行如下操作,若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH
 =amol/L,则
=amol/L,则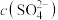 =
=(3)若要在铁制品表面镀镍,电镀液用硫酸镍溶液,则镍应与电源的
您最近一年使用:0次
解题方法
4 . 25℃时,现有浓度均为 的下列溶液
的下列溶液
①盐酸②醋酸③硫酸④氢氧化钠⑤氨水⑥醋酸铵⑦硫酸氢铵⑧氯化铵⑨碳酸氢铵请回答下列问题:
(1)①②③④⑤按PH由大到小的顺序是(填序号,下同)_____ 。
(2)⑤⑦⑧⑨四种溶液中 浓度由大到小的顺序是
浓度由大到小的顺序是_____ 。
(3)①②③④⑤五种溶液中水的电离程度由大到小的顺序为_____ (已知 、
、 )。
)。
(4)等浓度,等体积的①②③三种溶液,用等物质的量浓度的④溶液恰好完全中和时,消耗④溶液的体积由大到小顺序为_____ 。
(5)等体积,等pH①②③三种溶液,分别加入形状大小相同的镁片,开始产生气泡速率的关系为_____ 。
(6)⑥中的离子浓度由大到小的顺序为_____ 。
 的下列溶液
的下列溶液①盐酸②醋酸③硫酸④氢氧化钠⑤氨水⑥醋酸铵⑦硫酸氢铵⑧氯化铵⑨碳酸氢铵请回答下列问题:
(1)①②③④⑤按PH由大到小的顺序是(填序号,下同)
(2)⑤⑦⑧⑨四种溶液中
 浓度由大到小的顺序是
浓度由大到小的顺序是(3)①②③④⑤五种溶液中水的电离程度由大到小的顺序为
 、
、 )。
)。(4)等浓度,等体积的①②③三种溶液,用等物质的量浓度的④溶液恰好完全中和时,消耗④溶液的体积由大到小顺序为
(5)等体积,等pH①②③三种溶液,分别加入形状大小相同的镁片,开始产生气泡速率的关系为
(6)⑥中的离子浓度由大到小的顺序为
您最近一年使用:0次
名校
5 . 联氨( ,二元弱碱,无色油状液体)是一种用途广泛的化工原料,可用作火箭和燃料电池的燃料,在空气中能燃烧且产物无污染。
,二元弱碱,无色油状液体)是一种用途广泛的化工原料,可用作火箭和燃料电池的燃料,在空气中能燃烧且产物无污染。
(1)联氨属于______ (填“强电解质”或“弱电解质”),联氨在水中可分步电离,联氨在水中的第一步电离方程式为______ 。
(2)常温下,向 的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(
的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数( )变化如图所示
)变化如图所示 。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为______ :联氨的一级电离常数
______ .

(3)常温下,浓度均为 的
的 溶液和联氨水溶液等体积混合,则反应后溶液呈
溶液和联氨水溶液等体积混合,则反应后溶液呈______ (填“酸性”、“碱性”或“中性”)。
 ,二元弱碱,无色油状液体)是一种用途广泛的化工原料,可用作火箭和燃料电池的燃料,在空气中能燃烧且产物无污染。
,二元弱碱,无色油状液体)是一种用途广泛的化工原料,可用作火箭和燃料电池的燃料,在空气中能燃烧且产物无污染。(1)联氨属于
(2)常温下,向
 的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数(
的联氨水溶液中逐滴滴加一定浓度的稀盐酸,水溶液中部分微粒的物质的量分数( )变化如图所示
)变化如图所示 。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为
。该联氨水溶液中含氮元素的粒子的浓度由大到小的关系为

(3)常温下,浓度均为
 的
的 溶液和联氨水溶液等体积混合,则反应后溶液呈
溶液和联氨水溶液等体积混合,则反应后溶液呈
您最近一年使用:0次
2023-12-18更新
|
60次组卷
|
2卷引用:内蒙古呼和浩特市第一中学2023-2024学年高二上学期期中考试化学试题
6 . I.常温下,有浓度均为0.1 mol·L-l的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是_______ (填标号);①中各离子浓度由大到小的顺序是_______ 。
(2)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体③_______ ④(填“>”“<”或“=”)。
(3)25 ℃时,测得HCN和NaCN的混合溶液的pH=11,则 约为
约为_______ 。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_______ 。
II.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。

(4)该微生物燃料电池,负极为_______ (填“a”或“b”)。
(5)该电池正极电极反应式为_______ 。
(6)当电路中有0.5mol电子发生转移,则有_______ mol的H+通过质子交换膜。
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是
(2)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体③
(3)25 ℃时,测得HCN和NaCN的混合溶液的pH=11,则
 约为
约为II.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。

(4)该微生物燃料电池,负极为
(5)该电池正极电极反应式为
(6)当电路中有0.5mol电子发生转移,则有
您最近一年使用:0次
2022-12-14更新
|
113次组卷
|
2卷引用:内蒙古喀喇沁旗锦山蒙古族中学2021-2022学年高二上学期第二次调研考试化学试题
7 . 回答下列问题
(1)FeCl3水溶液呈酸性,原因是_______ (用离子方程式表示),实验室配制FeCl3溶液的方法是加入少量的_______ 。
(2)泡沫灭火器中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂。写出使用时发生反应的离子方程式:_______ 。
(3)把FeCl3 水溶液蒸干灼烧得到的固体物质是_______ ,把碳酸钾的水溶液蒸干得到的固体物质是_______ 。
(1)FeCl3水溶液呈酸性,原因是
(2)泡沫灭火器中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂。写出使用时发生反应的离子方程式:
(3)把FeCl3 水溶液蒸干灼烧得到的固体物质是
您最近一年使用:0次
解题方法
8 . Ⅰ.几种酸的电离常数如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol/L的①NaClO溶液 ②Na2CO3溶液 ③Na2SO3溶液,pH由大到小的顺序是_______ (填标号)。
(2)0.1mol/LNH4Cl溶液中各离子的物质的量浓度由大到小的顺序是_______ ,只改变下列一个条件,能使c( )与c(Cl-)的比值变大的是
)与c(Cl-)的比值变大的是_______ (填标号)。
A.加入(NH4)2SO4固体 B.通入少量HCl C.降低溶液温度 D.加入少量NaOH固体
Ⅱ.现有常温下的下列两组溶液:
第一组:0.1mol/L的CH3COOH溶液和0.1mol/L的盐酸;
第二组:c(OH-)均为0.1mol/L的NaOH溶液和氨水。
(3)在第一组溶液中,水的电离程度较大的是_______ ;在第二组溶液中,水的电离程度_______ (填“相同”或“不相同”)。
(4)在盐酸中,由水电离出的H+浓度为_______ 。
(5)若第二组溶液的体积相同,二者分别与盐酸完全中和,则消耗盐酸的量较多的是_______ 。
(6)将第一组溶液分别加水稀释相同的倍数,稀释后溶液中的c(H+)较大的是_______ 。
| 酸 | 电离方程式 | 电离常数 |
| HClO | HClO H++ClO- H++ClO- | Ka=4.0×10﹣8 |
| H2CO3 | H2CO3 H++ H++   H++ H++ | Ka1=4.5×10﹣7 Ka2=4.7×10﹣11 |
| H2SO3 | H2SO3 H++ H++   H++ H++ | Ka1=1.4×10﹣2 Ka2=6.0×10﹣8 |
(1)物质的量浓度均为0.1mol/L的①NaClO溶液 ②Na2CO3溶液 ③Na2SO3溶液,pH由大到小的顺序是
(2)0.1mol/LNH4Cl溶液中各离子的物质的量浓度由大到小的顺序是
 )与c(Cl-)的比值变大的是
)与c(Cl-)的比值变大的是A.加入(NH4)2SO4固体 B.通入少量HCl C.降低溶液温度 D.加入少量NaOH固体
Ⅱ.现有常温下的下列两组溶液:
第一组:0.1mol/L的CH3COOH溶液和0.1mol/L的盐酸;
第二组:c(OH-)均为0.1mol/L的NaOH溶液和氨水。
(3)在第一组溶液中,水的电离程度较大的是
(4)在盐酸中,由水电离出的H+浓度为
(5)若第二组溶液的体积相同,二者分别与盐酸完全中和,则消耗盐酸的量较多的是
(6)将第一组溶液分别加水稀释相同的倍数,稀释后溶液中的c(H+)较大的是
您最近一年使用:0次
名校
解题方法
9 . 按要求回答下列问题:
(1)25℃时,0.1mol/L的下列溶液:①KCl溶液、② 溶液、③
溶液、③ 溶液,④
溶液,④ 溶液,水的电离程度由大到小顺序为
溶液,水的电离程度由大到小顺序为_______ (填标号),0.1mol/L的 溶液中水电离出的
溶液中水电离出的
_______ mol/L。
(2)已知 的电离是分步进行的,常温下
的电离是分步进行的,常温下 ,
, ,
, ,
, 溶液显
溶液显_______ 性(填“酸”、“碱”或“中”),该溶液中
_______ 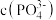 (填“>”或“<”)
(填“>”或“<”)
(3)25℃时,aL的盐酸和 的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若
的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若 ,则
,则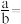
_______ (填数据)
(4)常温下, 溶液与
溶液与 溶液充分反应后,溶液
溶液充分反应后,溶液 ,则
,则 的电离常数
的电离常数
_______ (用含b的代数式表示)
(5)向含有 、
、 的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的 时,
时,
_______ [ ]
]
(1)25℃时,0.1mol/L的下列溶液:①KCl溶液、②
 溶液、③
溶液、③ 溶液,④
溶液,④ 溶液,水的电离程度由大到小顺序为
溶液,水的电离程度由大到小顺序为 溶液中水电离出的
溶液中水电离出的
(2)已知
 的电离是分步进行的,常温下
的电离是分步进行的,常温下 ,
, ,
, ,
, 溶液显
溶液显
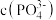 (填“>”或“<”)
(填“>”或“<”)(3)25℃时,aL的盐酸和
 的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若
的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若 ,则
,则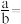
(4)常温下,
 溶液与
溶液与 溶液充分反应后,溶液
溶液充分反应后,溶液 ,则
,则 的电离常数
的电离常数
(5)向含有
 、
、 的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的 时,
时,
 ]
]
您最近一年使用:0次
10 . 水溶液中的行为是中学化学的重要内容。
(1)在某温度(T℃)的水溶液中,c(H+)=10xmol·L-1,c(OH-)=10ymol·L-1,x与y关系如图所示。

①该温度下,水的离子积为____ ,T℃____ 25℃(填“>”“<”或“=”)。
②将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为____ (已知lg5=0.7)。
(2)已知部分弱酸的电离常数如表:
①0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,c(CN-)____ c(HCO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:a.CH3COOHb.NaCNc.Na2CO3,其物质的量浓度由大到小的顺序是____ 。(填序号)
③将少量CO2通入NaCN溶液,反应的离子方程式是____ 。
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。
①25℃时,FeCl3溶液显酸性,原因是(用离子方程式表示)___ 。把FeCl3溶液蒸干灼烧得到的主要产物是___ 。
②某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1Cu2+,欲使Fe3+完全沉淀【c(Fe3+)≤4×10-5mol·L-1】而Cu2+不沉淀,则需控制溶液pH的范围为___ 。【Ksp[Cu(OH)2]=2.6×10-19;Ksp[Fe(OH)3]=4×10-38】
(1)在某温度(T℃)的水溶液中,c(H+)=10xmol·L-1,c(OH-)=10ymol·L-1,x与y关系如图所示。

①该温度下,水的离子积为
②将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为
(2)已知部分弱酸的电离常数如表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。②常温下,pH相同的三种溶液:a.CH3COOHb.NaCNc.Na2CO3,其物质的量浓度由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。
①25℃时,FeCl3溶液显酸性,原因是(用离子方程式表示)
②某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1Cu2+,欲使Fe3+完全沉淀【c(Fe3+)≤4×10-5mol·L-1】而Cu2+不沉淀,则需控制溶液pH的范围为
您最近一年使用:0次



