名校
1 . 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)CO2的电子式是_____________ ,所含化学键的类型是______________ 。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
①写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式___________________ 。
②一定条件下,上述合成二甲醚的的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是(只有一个选项符合题意)_________ (填字母代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.CO2的体积百分含量减小
d.容器中c(H2)/c(CO2)的值减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如右图所示。T1温度下,将6 molCO2和12 molH2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=___________ ;KA、KB、KC三者之间的大小关系为__________________ 。

(3)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显________ ;(填“酸性”、“中性”或“碱性”);请计算反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=_________ 。
(1)CO2的电子式是
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-12CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1①写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式
②一定条件下,上述合成二甲醚的的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是(只有一个选项符合题意)
a.逆反应速率先增大后减小
b.H2的转化率增大
c.CO2的体积百分含量减小
d.容器中c(H2)/c(CO2)的值减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如右图所示。T1温度下,将6 molCO2和12 molH2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=

(3)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显
 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2016-12-09更新
|
552次组卷
|
2卷引用:2016届广东省韶关市高三1月调研测试理综化学试卷
名校
解题方法
2 . 二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是________________ 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
③ H2O(1) =H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________ ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
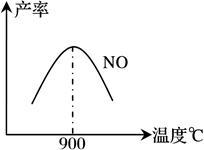
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为______________ ,请用化学反应速率和化学平衡理论解释其原因:____________________ 。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________ 。
(1)CO2的电子式是
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1③ H2O(1) =H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为
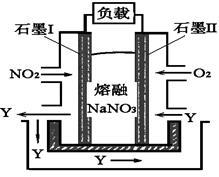
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2016-12-09更新
|
537次组卷
|
3卷引用:2016届广东省清远市高三上学期期末考试化学试卷
2013·广东潮州·二模
名校
3 . 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如图:
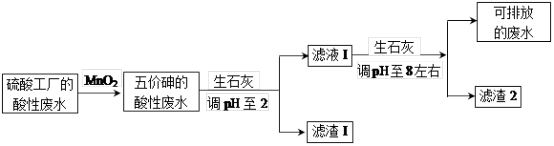
相关数据如表,请回答以下问题:
表1.几种盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=_______ mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO )=
)=_______ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为_______ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为_______ 。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=_______ 。Na3AsO4的第一步水解的离子方程式为:AsO +H2O⇌HAsO
+H2O⇌HAsO +OH-,该步水解的平衡常数(25℃)为:
+OH-,该步水解的平衡常数(25℃)为:_______ (保留两位有效数字)。

相关数据如表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO
 )=
)=(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=
 +H2O⇌HAsO
+H2O⇌HAsO +OH-,该步水解的平衡常数(25℃)为:
+OH-,该步水解的平衡常数(25℃)为:
您最近一年使用:0次



