名校
1 . 已知某平衡常数表达式K=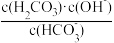 ,则该表达式对应的反应方程式为
,则该表达式对应的反应方程式为
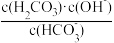 ,则该表达式对应的反应方程式为
,则该表达式对应的反应方程式为A.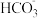 +H2O⇌ +H2O⇌ +H3O+ +H3O+ | B.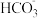 +OH—= +OH—=  + H2O + H2O |
C.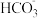 +H2O⇌H2CO3+OH— +H2O⇌H2CO3+OH— | D.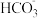 +H+⇌CO2 + H2O +H+⇌CO2 + H2O |
您最近一年使用:0次
2021-01-15更新
|
92次组卷
|
2卷引用:广东省东莞市东华高级中学2021届高三上学期第二次月考化学试题
名校
解题方法
2 . 在某温度时,将n mol∙L-1氨水滴入10 mL 1.0 mol∙L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
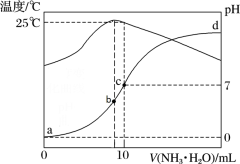

| A.a点Kw = 1.0×10-14 |
| B.b点:c(NH3∙H2O) + c(OH-) < c(H+) |
| C.25℃时,NH4Cl水解平衡常数为(n-1)×10-7(用n表示) |
| D.d点水的电离程度最大 |
您最近一年使用:0次
2021-01-07更新
|
819次组卷
|
7卷引用:广东省汕头市潮阳实验学校2021届高三下学期第二次月考化学试题
广东省汕头市潮阳实验学校2021届高三下学期第二次月考化学试题山东省济南市2021届高三上学期期中考试化学试题福建省漳州市2021届高三毕业班适应性测试(一)化学试题(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅰ卷)(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅲ卷)山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题
名校
3 . 室温下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中lgc(Ba2+)与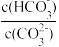 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是
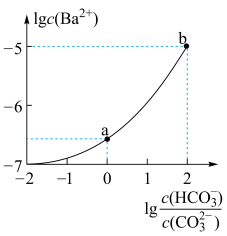
(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)
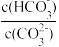 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是 
(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)
| A.a对应溶液的pH小于b |
| B.b对应溶液的c(H+)=4.2×10-7mol·L-1 |
C.a→b 对应的溶液中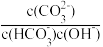 减小 减小 |
D.a 对应的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c( )+c(Cl-)+c(OH-) )+c(Cl-)+c(OH-) |
您最近一年使用:0次
2020-10-21更新
|
692次组卷
|
7卷引用:广东省广州、深圳市学调联盟2020届高三第二次调研考试化学试题
名校
解题方法
4 . 25℃时, 用0.10mol/L的氨水滴定10.00mL 0.05mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )
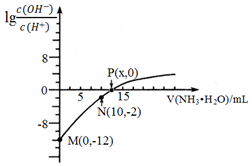
 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )
| A.H2A为强电解质,是一种强酸 |
| B.M、N、P三点的溶液中,水电离程度最大的是N点 |
C.P点溶液中,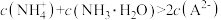 |
| D.25℃时,氨水的电离平衡常数:K=10-7/(0.2x-1) |
您最近一年使用:0次
2020-09-07更新
|
1700次组卷
|
2卷引用:广东省广州市四校(天河省实)2019-2020学年高二下学期期末联考化学试题
名校
5 . 常温下,用0.1000mol∙L-1NaOH溶液滴定20.00mL0.1000mol∙L-1某一元酸HA溶液,所滴定曲线如图所示。下列说法不正确的是(忽略溶液体积变化)
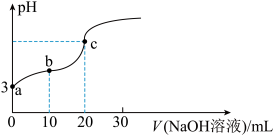

| A.c点溶液显碱性,c(A-)+c(HA)=0.1000mol∙L-1 |
| B.a、b、c三点溶液的导电性依次增强 |
| C.NaA的水解常数Kh≈1.0×10-9 |
| D.b点溶液中,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
您最近一年使用:0次
2020-08-28更新
|
138次组卷
|
2卷引用:广东省茂名市五校联盟2019-2020学年高二下学期期末联考化学试题
6 . (1)物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液的pH______ 7(选填“>”“<”或“=”,下同),所用醋酸体积______ 氢氧化钠溶液体积。
(2)亚磷酸(H3PO3)是二元弱酸,已知常温下H3PO3的电离常数的值:Ka1=3.7×10-2,Ka2=2.9×10-7。则NaH2PO3溶液显______ 性(选填“酸”“碱”或“中”)。
(3)某化学兴趣小组利用0.1mol/L的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。①已知亚磷酸(H3PO3)具有较强的还原性,能被酸性KMnO4溶液氧化为磷酸,且磷酸在水溶液中主要以分子形式存在,请写出该滴定反应的离子方程式:______ 。
②该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,用上述酸性KMnO4标准溶液进行滴定,三次滴定的测量数据如下:
则滴定终点的现象为:______ 。该亚磷酸溶液的物质的量浓度为______ mol/L。
(2)亚磷酸(H3PO3)是二元弱酸,已知常温下H3PO3的电离常数的值:Ka1=3.7×10-2,Ka2=2.9×10-7。则NaH2PO3溶液显
(3)某化学兴趣小组利用0.1mol/L的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。①已知亚磷酸(H3PO3)具有较强的还原性,能被酸性KMnO4溶液氧化为磷酸,且磷酸在水溶液中主要以分子形式存在,请写出该滴定反应的离子方程式:
②该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,用上述酸性KMnO4标准溶液进行滴定,三次滴定的测量数据如下:
| 实验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
则滴定终点的现象为:
您最近一年使用:0次
7 . 某温度下,氢氟酸与丙酸的Ka值分别为6.8×10-4和1.34×10-5。将物质的量浓度和体积均相同的两种酸溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
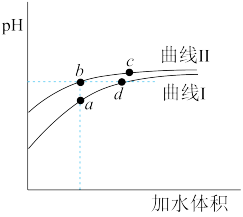

| A.曲线Ⅰ代表丙酸溶液 |
| B.溶液中水的电离程度:a>b |
C.从b点到c点,溶液中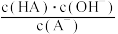 保持不变(HA、A-分别代表相应的酸和酸根离子) 保持不变(HA、A-分别代表相应的酸和酸根离子) |
| D.取体积相同的b、d两点溶液分别与NaOH恰好中和,d点消耗的NaOH多 |
您最近一年使用:0次
2020-07-28更新
|
589次组卷
|
6卷引用:广东省深圳市福田区外国语高级中学2022-2023学年高二上学期期中考试化学试题
8 . 常温下,H2A和H2NCH2CH2NH2溶液中各组分的物质的量分数δ随pH的变化如图(I)、(II)所示。下列说法正确的是
已知:H2NCH2CH2NH2+H2O [H3NCH2CH2NH2]++OH-
[H3NCH2CH2NH2]++OH-
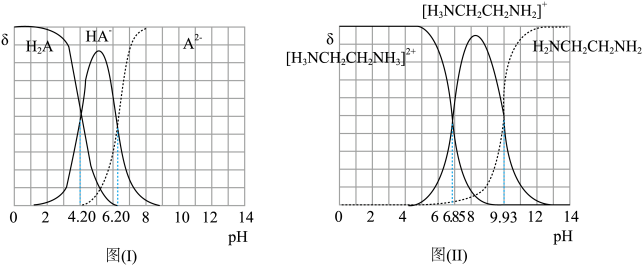
已知:H2NCH2CH2NH2+H2O
 [H3NCH2CH2NH2]++OH-
[H3NCH2CH2NH2]++OH-
| A.NaHA溶液中各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(OH-)>c(A2-) |
| B.乙二胺(H2NCH2CH2NH2)的Kb1=10-4.07 |
| C.[H3NCH2CH2NH3]A溶液显碱性 |
D.向[H3NCH2CH2NH2]HA溶液中通入HCl, 增大 增大 |
您最近一年使用:0次
9 . 25°C时,向50 mL浓度均为1.0 mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0 mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知: 25°C时,Ka(CH3COOH) =1.8×10—5)。下列叙述错误的是
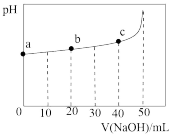

| A.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大 |
| B.b点溶液中,c(Na+)>c(CH3COOH) |
| C.a点溶液中,c(H+)约为1.8×10-5 mol/L |
D.从a到c的过程中,溶液中 不变 不变 |
您最近一年使用:0次
名校
10 . 室温下,某二元碱 水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
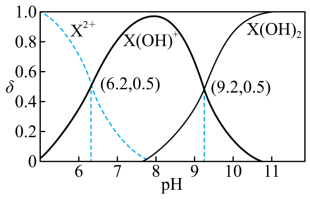
 水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
A. 的数量级为 的数量级为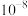 |
B.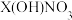 水溶液显碱性 水溶液显碱性 |
C.等物质的量的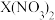 和 和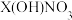 混合溶液中 混合溶液中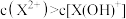 |
D.在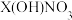 水溶液中, 水溶液中,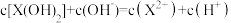 |
您最近一年使用:0次
2020-06-18更新
|
861次组卷
|
13卷引用:广东省广州市广大附中、广外2020-2021学年高二上学期期中考试化学试题
广东省广州市广大附中、广外2020-2021学年高二上学期期中考试化学试题【全国百强校】福建省厦门外国语学校2018届高三下学期5月适应性考试(最后压轴模拟)理综-化学试题(已下线)2018届高三高考题及模拟题汇编 专题10 水溶液中的离子平衡江西省南昌市第十中学2019-2020学年高二上学期期末考试化学试题四川省遂宁市第二中学2020届高三上学期第三次高考模拟理综化学试题(已下线)【南昌新东方】2019 南昌市三校(一中、十中、铁一中)高二上 期末宁夏吴忠市2020届高三一轮联考理科综合化学试题山东省济宁市2020届高三一模化学试卷江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)辽宁省凌源市实验中学2022-2023学年高二下学期4月月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高二下学期5月月考化学试题



