1 . 25℃时,向50mL浓度均为l.0mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知:25℃时,Ka(CH3COOH)=1.8×10-5)。下列叙述错误的是
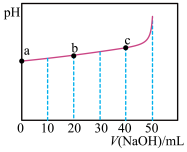

A.a点溶液中,c(H+)约为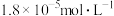 |
B.b点溶液中, |
| C.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大 |
D.从a到c的过程中,溶液中 不变 不变 |
您最近一年使用:0次
2020-06-12更新
|
423次组卷
|
2卷引用:广东省深圳市2020年6月高三年级第二次调研考试理综化学试题
2 . 下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 减小 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中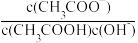 增大 增大 |
C.向盐酸中加入氨水至中性,溶液中 >1 >1 |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 不变 不变 |
您最近一年使用:0次
2020-06-05更新
|
2257次组卷
|
42卷引用:广东省湛江市2019-2020学年高二上学期期末考试化学试题
广东省湛江市2019-2020学年高二上学期期末考试化学试题广东省揭阳市普宁市华侨中学2021-2022学年高二下学期第三次月考化学试题(已下线)广东省深圳中学2023届高三年级上学期第二次阶段测试化学试题(A卷)四川省遂宁市船山区第二中学校2019-2020学年高二下学期期中考试化学试题福建省福清市龙西中学2018-2019学年高二下学期期中考试化学试题广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期第一次月考化学试题(已下线)第03章 水溶液中的离子平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)福建省泰宁第一中学2020届高三上学期第一阶段考试化学试题山西省运城市新绛中学2021届高三上学期8月月考化学试题重庆市万州第二高级中学2020-2021学年高二上学期10月月考化学试题内蒙古通辽市开鲁县第一中学2021届高三上学期第二次阶段性考试化学试题四川省成都实验中学2021届高三上学期10月月考理综化学试题福建师范大学第二附属中学2019-2020学年高二上学期期末考试化学试题重庆市第二十九中学2020-2021学年高二10月月考化学试题湖南省雅礼中学2020-2021学年高二上学期第三次月考化学试题四川省邻水实验学校2020-2021学年高二上学期第三阶段考试化学试题山西省运城市临猗县临晋中学2020-2021学年高二上学期12月月考化学试题宁夏银川市长庆高级中学2020-2021学年高二上学期期末考试化学试题福建省莆田第一中学2020-2021学年高二上学期期末考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题江苏省苏州工业园区星海实验中学2019-2020学年高二下学期期中考试化学试卷西藏日喀则市上海实验学校2019-2020学年高二上学期期末考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)四川省遂宁市第二中学2020-2021学年高二下学期期中考试化学试题云南省楚雄天人中学2019-2020学年高二4月学习效果监测化学试题四川省北大成都附属实验学校2020-2021学年高二下学期入学考试化学试题江西省吉安市2020-2021学年高二上学期期中统考化学试题宁夏吴忠中学2021-2022学年高二上学期期末考试化学试题黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)四川省峨眉第二中学校2021-2022学年高二下学期5月月考化学试题江苏省天一中学2021-2022学年高二上学期期末考试化学试题黑龙江省哈尔滨市第六中学2022-2023学年高三8月月考化学试题四川省内江市第三中学2021-2022学年高二下学期期中考试化学试题四川省自贡市田家柄中学教育集团2021-2022学年高二下学期入学考试化学试题四川省宜宾市南溪区第二中学校2021-2022学年高二上学期12月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高二上学期期末考试化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)湖南省岳阳市华容县2022-2023学年高二上学期期末考试化学试题贵州省瓮安中学2022-2023学年高二下学期3月月考化学试题(已下线)专题10 溶液中离子浓度的关系(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练
名校
3 . 25℃时,NaCN溶液中CN-、HCN浓度所占分数( )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
 )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的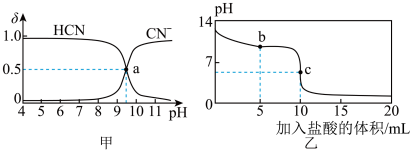
| A.图甲中pH=7的溶液:c(Cl-)=c(HCN) |
| B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L |
| C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) |
| D.图乙中c点的溶液:c(Na+)+ c(H+)= c(HCN)+ c(OH-)+ c(CN-) |
您最近一年使用:0次
2020-04-26更新
|
284次组卷
|
6卷引用:【市级联考】广东省惠州市2019届高三下学期4月模拟考试理科综合化学试题
名校
解题方法
4 . 根据表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Kii=4.3×10-7 |
| Ki2=5.6×10-11 |
| A.c(HCO3-)> c(ClO-)> c(OH-) |
| B.c(ClO-)> c(HCO3-)> c(H+) |
| C.c(ClO-)+ c(HClO)= c(HCO3-)+ c(H2CO3) |
| D.c(Na+)+ c(H+)= c(HCO3-)+ c(ClO-)+c(OH-) |
您最近一年使用:0次
2020-03-31更新
|
153次组卷
|
12卷引用:广东省汕头市金山中学2020-2021学年高二下学期期中考试化学试题
广东省汕头市金山中学2020-2021学年高二下学期期中考试化学试题2016届浙江省温州市十校联合体高三上学期期初联考化学试卷2015-2016学年山东省济宁市高二上学期期末考试化学试卷2015-2016学年福建省泉州市四校高二上学期期末化学试卷宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题2018-2019学年鲁科版高中化学选修四:第3章检测题【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期中考试化学试题2福建省福州市八县一中2019-2020学年高二年上学期期末联考化学试题(已下线)上海市长宁区2012届高三上学期期末质量抽测化学试题河南省焦作市博爱县英才学校2020-2021学年高二上学期11月月考化学试题浙江省台州市七校联盟2019-2020学年高二上学期期中联考化学试题山东省德州市2020-2021学年高二上学期反应原理月考(A)化学试题
名校
5 . 常温下,用0.1mol·L-1HCl溶液滴定0.1mol·L-1 NH3·H2O溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列说法不正确的是
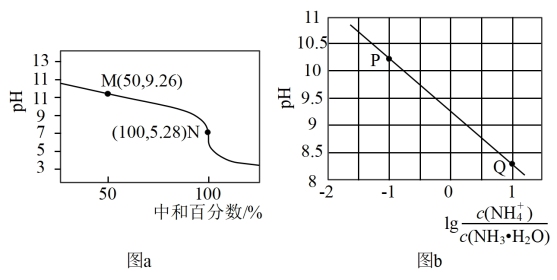

| A.Kb(NH3·H2O)的数量级为10-5 |
| B.P到Q过程中,水的电离程度逐渐增大 |
| C.当滴定至溶液呈中性时,c(NH4+)>c(NH3·H2O) |
D.N点,c(Cl- ) - c(NH4+)=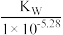 |
您最近一年使用:0次
2020-03-19更新
|
752次组卷
|
6卷引用:广东省汕头市潮阳黄图盛中学2021-2022学年高三下学期一模检验化学试题
名校
解题方法
6 . 硒是典型的半导体材料,在光照射下导电性可提高近千倍。如图是从某工厂的硒化银半导体废料(含Ag2SeO、Cu 单质)中提取硒、银的工艺流程图:
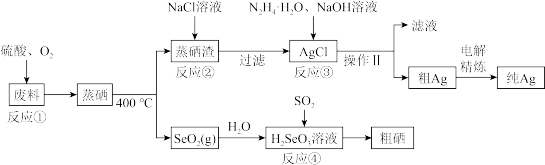
回答下列问题:
(1)写出 Se 的原子结构示意图_______ 。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子程式_______ 。
(3)已知:常温下Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示,反应②为_______ (写离子方程式);该反应的化学平衡常数的数量级为_______ 。

(4)写出反应④的化学方程式________ 。
(5)室温下,H2SeO3水溶液中的H2SeO3、HSeO3-、SeO32-摩尔分数随 pH 的变化如图 所示,则室温下 SeO32-的 Kh_______ 。

(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生_______ (写电极反应式),若用 10A的电流电解60min后,得到32.4g Ag,则该电解池的电解效率为_______ (保留小数点后一位)。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率,法拉第常数为96500C·mol-1。

回答下列问题:
(1)写出 Se 的原子结构示意图
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子程式
(3)已知:常温下Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示,反应②为

(4)写出反应④的化学方程式
(5)室温下,H2SeO3水溶液中的H2SeO3、HSeO3-、SeO32-摩尔分数随 pH 的变化如图 所示,则室温下 SeO32-的 Kh

(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生
您最近一年使用:0次
7 . 25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )
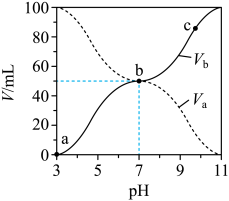

| A.Ka(HA)=1×10-6mol/L |
| B.b点c(B+)=c(A-)=c(OH-)=c(H+) |
C.c点时, 随温度升高而减小 随温度升高而减小 |
| D.a→c过程中水的电离程度始终增大 |
您最近一年使用:0次
2020-02-08更新
|
441次组卷
|
23卷引用:2017届广东省深圳市高三2月第一次调研(一模)理综化学试卷
2017届广东省深圳市高三2月第一次调研(一模)理综化学试卷广东省深圳市高级中学2017-2018学年高二上学期期中考试化学试题山东省日照市第一中学2017届高三4月“圆梦之旅”(九)理综化学试题福建省厦门市第一中学2016-2017学年高二下学期期中考试化学试题山西省山西大学附属中学2017届高三下学期3月模块诊断理科综合化学试题河北省衡水中学2017届高三第二次模拟考试理科综合化学试题福建省厦门第一中学2017届高三高考考前模拟考试理综化学试题河南省商丘市第一高级中学2017-2018学年高二10月月考化学试题河南省商丘市第一高级中学2017-2018学年高二上学期10月份月考化学试题四川省石室中学2017-2018学年高二上学期半期考试化学试题福建省三明市第一中学2017-2018学年高二下学期开学考试化学试题【全国市级联考】福建省漳州市2018届高三考前模拟考试试卷(二)化学试题四川省成都市外国语学校2019届高三上学期开学考试化学试题福建省漳州市龙海市第二中学2020届高三上学期第二次月考化学试题陕西省西安中学2019-2020学年高二12月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——电解质溶液中的曲线问题(提升练习)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——电解质溶液中的曲线问题山西省太原市第五中学2020届高三二诊理综化学试题(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编山西省忻州市第一中学2019-2020学年高二下学期期中考试化学试题新疆克拉玛依市2017届高三第三次模拟检测理综化学试题福建省泰宁第一中学2020届高三上学期第一阶段考试化学试题(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题
名校
解题方法
8 . H2C2O4是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,下列溶液的离子浓度关系式正确的是
A.pH=2的H2C2O4溶液中,c(H+)=c( )=10-2mol•L-1 )=10-2mol•L-1 |
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c( ) ) |
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c( )>c( )>c( ) ) |
D.NaHC2O4溶液中:c(Na+)>c( )>c(H2C2O4)>c( )>c(H2C2O4)>c( ) ) |
您最近一年使用:0次
2020-02-08更新
|
80次组卷
|
6卷引用:广东省梅州市五华县五华中学2021届高三2月测练化学试题
名校
9 . 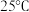 时,
时, 的
的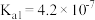 ,
,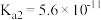 ,室温下向10mL
,室温下向10mL 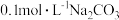 溶液中逐滴加入
溶液中逐滴加入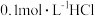 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象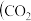 因有逸出未画出
因有逸出未画出 。下列说法错误的是
。下列说法错误的是
 时,
时, 的
的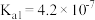 ,
,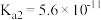 ,室温下向10mL
,室温下向10mL 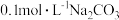 溶液中逐滴加入
溶液中逐滴加入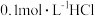 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象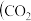 因有逸出未画出
因有逸出未画出 。下列说法错误的是
。下列说法错误的是
A.A点所示溶液的 |
B.B点所示溶液: |
C.A点 点发生反应的离子方程式为 点发生反应的离子方程式为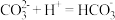 |
D.分步加入酚酞和甲基橙,用滴定法可测定 与 与 混合物的组成 混合物的组成 |
您最近一年使用:0次
2020-01-27更新
|
277次组卷
|
6卷引用:广东省深圳中学2018届高三上学期第一次阶段性检测化学试题
名校
10 . 25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。
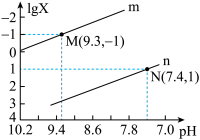
已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列叙述正确的是( )

已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列叙述正确的是( )
| A.曲线m表示pH与c(HCO3-)/c(H2CO3)的变化关系 |
| B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-) |
| C.Ka1(H2CO3)=1.0×10-6.4 |
D.25 ℃时,CO32-+H2O HCO3-+OH-的平衡常数为1.0×10-7.6 HCO3-+OH-的平衡常数为1.0×10-7.6 |
您最近一年使用:0次
2019-08-04更新
|
720次组卷
|
2卷引用:广东省深圳市高级中学2020届高三上学期理科综合测试二—化学试题



