名校
1 . 已知联氨( )为二元弱碱,常温下联氨的水溶液中有:
)为二元弱碱,常温下联氨的水溶液中有: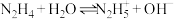
 ;
;
 。常温下向10mL
。常温下向10mL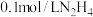 的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数
的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数 随
随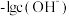 变化的关系如下图所示下列叙述正确的是
变化的关系如下图所示下列叙述正确的是
 )为二元弱碱,常温下联氨的水溶液中有:
)为二元弱碱,常温下联氨的水溶液中有: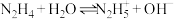
 ;
;
 。常温下向10mL
。常温下向10mL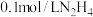 的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数
的水溶液中滴加0.1mol/L盐酸溶液,混合溶液中微粒的物质的量分数 随
随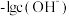 变化的关系如下图所示下列叙述正确的是
变化的关系如下图所示下列叙述正确的是
A.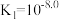 |
| B.常温下滴加5mL盐酸溶液时,混合溶液pH=8 |
C.混合溶液中 时,滴加盐酸溶液体积小于10mL 时,滴加盐酸溶液体积小于10mL |
D.常温下,当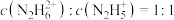 时,溶液中 时,溶液中 |
您最近一年使用:0次
2022-02-05更新
|
502次组卷
|
4卷引用:广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题
2 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中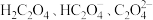 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
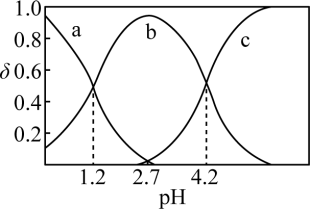
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中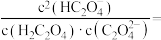
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③ 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中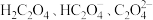 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中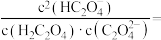
②pH从1.2增大至4.2的过程中,水的电离程度
③
 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:广东省湛江市2021-2022学年高二上学期期末调研考试化学试题
名校
3 . 已知: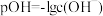 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是
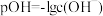 ,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随
,它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随 上的变化如图所示。下列说法错误的是
上的变化如图所示。下列说法错误的是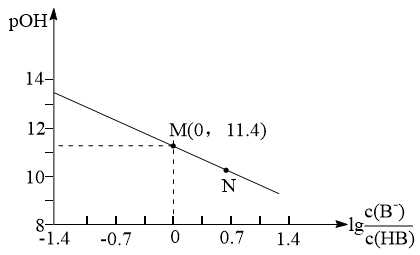
| A.当酸碱完全中和时,水的电离程度最大 |
B.室温下,HB的Ka数量级为 |
| C.将HB与NaB两溶液等体积等浓度混合,所得溶液呈碱性 |
D.N点对应溶液中: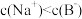 |
您最近一年使用:0次
2022-01-02更新
|
344次组卷
|
4卷引用:广东省东莞市常平中学2023-2024学年高二下学期期中考试化学试卷
4 . 25℃时,用浓度为 的
的 溶液滴定
溶液滴定 浓度为
浓度为 的
的 溶液,滴定曲线如图所示。下列说法
溶液,滴定曲线如图所示。下列说法错误 的是。

 的
的 溶液滴定
溶液滴定 浓度为
浓度为 的
的 溶液,滴定曲线如图所示。下列说法
溶液,滴定曲线如图所示。下列说法
| A.应选用酚酞作指示剂 |
B. 点溶液中存在: 点溶液中存在: |
C.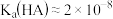 |
D.N点溶液中存在: |
您最近一年使用:0次
2021-10-14更新
|
648次组卷
|
19卷引用:广东省潮州市2020-2021学年高三上学期期末考试化学试题
广东省潮州市2020-2021学年高三上学期期末考试化学试题河南省顶级名校2020届高三上学期开学摸底考试化学试题江西省宜春市宜丰中学2020届高三上学期第一次月考化学试题黑龙江省大庆市铁人中学2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练 ——选修四化学反应原理——电离平衡常数及其影响因素专练 (2)安徽省黄山市2019-2020学年高二下学期期末考试化学试题黑龙江省大兴安岭漠河县高级中学2019-2020学年高二上学期期中考试化学试题陕西省咸阳市永寿县中学2021届高三上学期开学考试(摸底)化学试题(已下线)3.2.2+pH的计算及其应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)辽宁省2020-2021学年高二上学期选科新题型测化学试题(已下线)3.2.1 水的电离和溶液的酸碱性(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)河北省石家庄市师大附中2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)周末培优3 盐类的水解-2021-2022学年高二化学课后培优练(人教版选修4)贵州省黔西南顶效开发区顶兴学校2021-2022学年高二下学期入学考试化学试题黑龙江省哈尔滨市宾县第一中学校2021-2022学年高二上学期第二次月考化学试题陕西省延安市富县高级中学2021-2022学年高二上学期期中考试化学试题辽宁省盘锦市高级中学2023-2024学年高二上学期12月阶段联考化学试卷
5 . 已知:25℃时,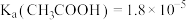 ,
, 下列说法正确的是
下列说法正确的是
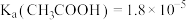 ,
, 下列说法正确的是
下列说法正确的是A.25℃时, 的水解常数 的水解常数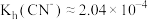 |
B.25℃时,反应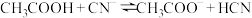 的平衡常数 的平衡常数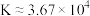 |
C.同浓度的 溶液和NaCN溶液中, 溶液和NaCN溶液中, 溶液的离子总浓度较小 溶液的离子总浓度较小 |
| D.若加水稀释醋酸溶液,溶液中所有离子浓度均减小 |
您最近一年使用:0次
名校
6 . 常温下,已知:一元弱酸(HR)的Ka=2.95×10-8,二元弱酸(H2M)的Ka1=4.3×10-7、Ka2=5.6×10-11。下列说法正确的是
| A.0.1 mol·L-1的NaHM溶液显碱性 |
| B.等浓度的NaR溶液与NaHM溶液相比,前者pH小 |
| C.向NaR溶液中加入少量H2M,发生反应的离子方程式为2R-+H2M=2HR+M2- |
| D.pH相等的HR溶液和H2M溶液分别与相同的NaOH溶液反应,消耗的NaOH溶液体积相等 |
您最近一年使用:0次
2021-06-10更新
|
127次组卷
|
3卷引用:广东省深圳市罗湖区翠园中学2022-2023高二上学期期中考试化学试题
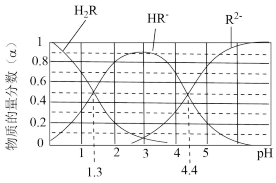
7 . 已知:常温下, 的
的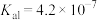 ,
, ;某二元酸
;某二元酸 及其钠盐的溶液中,
及其钠盐的溶液中, 、
、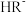 、
、 分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
 的
的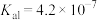 ,
, ;某二元酸
;某二元酸 及其钠盐的溶液中,
及其钠盐的溶液中, 、
、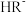 、
、 分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
分别所占的物质的量分数(α)随溶液pH变化关系如图所示。下列叙述错误的是
A.在 的溶液中: 的溶液中: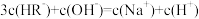 |
| B.等体积等浓度的NaOH溶液与H2R溶液混合,所得溶液中水的电离程度比纯水小 |
C.向 溶液中加入少量H2R溶液,发生反应: 溶液中加入少量H2R溶液,发生反应: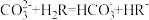 |
D.在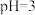 的溶液中,三种微粒的浓度满足关系: 的溶液中,三种微粒的浓度满足关系: |
您最近一年使用:0次
名校
解题方法
8 . 已知:25℃时,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。用0.01 mol/L的CH3COOH溶液滴定20 mL由浓度均为0.01 mol/L的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是
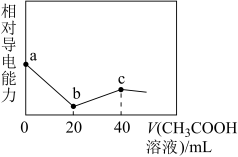
A.a点时混合溶液中:c( )≈1.7×10-5 mol·L-1 )≈1.7×10-5 mol·L-1 |
B.b点时混合溶液中:c(CH3COOH)<c( ) ) |
C.c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+) )+c(NH3·H2O)+c(Na+) |
| D.c点时混合溶液中:pH=7 |
您最近一年使用:0次
2021-05-13更新
|
966次组卷
|
11卷引用:广东省肇庆市百花中学2021届高三下学期5月模拟考试化学试题
广东省肇庆市百花中学2021届高三下学期5月模拟考试化学试题福建省莆田市2021届高三第三次质量检测化学试题辽宁省朝阳市2021届高三第三次模拟考试化学试题山东省泰安市与济南章丘区2021届高三5月联合模拟考试化学试题山西省2020-2021学年高二下学期5月考试化学试题湖南省长沙市明德中学2021届高三下学期第三次模拟考试化学试题湖北省十堰市2020-2021学年高二下学期期末调研考试化学试题(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练湖南省汨罗市第二中学2021-2022学年高三下学期4月月考化学试题2024届重庆市高三下学期二模考试化学试题陕西省西安市5校联考2023-2024学年高二上学期1月期末化学试题
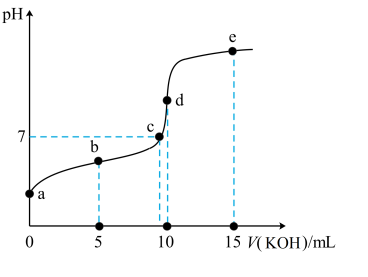
9 . 常温下,用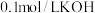 溶液滴定
溶液滴定 溶液的滴定曲线如图所示。下列说法错误的是
溶液的滴定曲线如图所示。下列说法错误的是
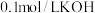 溶液滴定
溶液滴定 溶液的滴定曲线如图所示。下列说法错误的是
溶液的滴定曲线如图所示。下列说法错误的是
| A.根据c点或d点可以确定HA是弱酸 |
B.若 ,则HA的电离平衡常数为 ,则HA的电离平衡常数为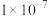 |
C.e点溶液中: |
D.对d点溶液加热 不考虑挥发 不考虑挥发 ,则 ,则 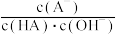 一定增大 一定增大 |
您最近一年使用:0次
2021-04-29更新
|
455次组卷
|
2卷引用:广东省汕头市第一中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
10 . 25℃时,用1.00 mol·L-1 NaOH溶液调节100 mL某二元弱酸H2A的pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示。下列说法正确的是
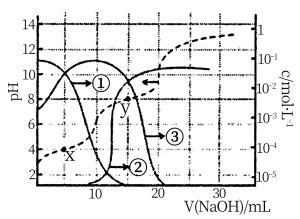

| A.曲线②代表c(HA-),曲线③代表c(A2-),H2A的Ka2=10-8 |
| B.x点溶液中,n(Na+)=n(H2A)+n(HA-)+n(A2-) |
| C.在Y点溶液中,c(Na+)>3c(A2-) |
| D.0.1000 mol·L-1 NaHA溶液中,c(Na+)>c(HA-)>c(H2A)>c(A2-) |
您最近一年使用:0次
2021-04-28更新
|
340次组卷
|
3卷引用:广东广雅中学2022届高三下学期4月测试化学试题



