广东省东莞市东华高级中学2021届高三上学期第二次月考化学试题
广东
高三
阶段练习
2021-02-11
383次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学反应原理、认识化学科学、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
| A.豆浆煮沸后,植物蛋白质变成了β-氨基酸 |
| B.“84”消毒液与酒精消毒液的消毒原理不相同 |
| C.疫苗抗原蛋白成分的免疫功能在高温时最有效 |
| D.病毒属于小分子蛋白质,戴口罩不能有效预防传染 |
①C(石墨,s)+
 O2(g)=CO(g) ΔH1
O2(g)=CO(g) ΔH1②CO2(g)=C(石墨,s)+O2(g) ΔH2
③H2(g)+
 O2(g)=H2O(g) ΔH3
O2(g)=H2O(g) ΔH3④CO(g)+H2O(g=CO2(g)+H2(g) ΔH4
下列说法正确的是
| A.ΔH1>0 | B.反应②的活化能为ΔH2 |
| C.H2的燃烧热是ΔH3 | D.ΔH4=-(ΔH1+ΔH2+ΔH3) |
【知识点】 燃烧热概念解读 盖斯定律与热化学方程式解读
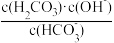 ,则该表达式对应的反应方程式为
,则该表达式对应的反应方程式为A.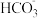 +H2O⇌ +H2O⇌ +H3O+ +H3O+ | B.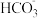 +OH—= +OH—=  + H2O + H2O |
C.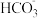 +H2O⇌H2CO3+OH— +H2O⇌H2CO3+OH— | D.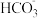 +H+⇌CO2 + H2O +H+⇌CO2 + H2O |
【知识点】 化学平衡常数的影响因素及应用解读 盐的水解常数解读
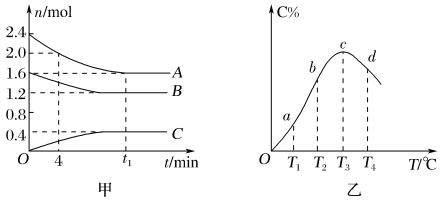
下列分析不正确的是
| A.0~4 min时,A的平均反应速率为0.02 mol·L-1·min-1 |
| B.该反应的化学方程式为2A(g)+B(g)⇌C(g) |
| C.由T1向T2变化时,正反应速率大于逆反应速率 |
| D.该反应正反应是放热反应 |
| A.标准状况下,5.6 L一氯甲烷中共价键数目为NA |
B.0.5 mol/L的NH4NO3溶液中 数目为0.5NA 数目为0.5NA |
| C.足量的氢气和1mol N2一定条件下反应,生成NH3的分子数最多为2NA |
| D.常温常压下,1.8 g重水(D2O)含有的电子数是NA |
【知识点】 阿伏加德罗常数的应用解读 结合气体物质与NA相关推算解读
| A.用盐酸酸化的硝酸银溶液,检验C2H5Cl中的氯元素 |
| B.提高KMnO4溶液的氧化能力:用草酸(H2C2O4)酸化 |
| C.探究淀粉水解产物:用硝酸酸化的银氨溶液 |
D.检验溶液中是否有SO :先将待测液用盐酸酸化,再滴加入BaCl2溶液 :先将待测液用盐酸酸化,再滴加入BaCl2溶液 |
【知识点】 硫酸根离子的检验解读 卤代烃中卤素原子的检验解读 淀粉、纤维素的水解
① 向含有淀粉的酸性KIO3溶液中逐滴滴加NaHSO3溶液,观察到溶液先变蓝后褪色
② 向含有淀粉的NaHSO3溶液中滴加过量KIO3酸性溶液,溶液变蓝,不褪色。对上述过程的分析,不合理的是
A.①变蓝是先发生了反应:2IO +5HSO +5HSO =I2+5SO =I2+5SO + H2O+3H+ + H2O+3H+ |
B.①褪色是后发生了反应 :I2+ HSO + H2O = 2I-+SO + H2O = 2I-+SO +3H+ +3H+ |
| C.①溶液恰好褪色时n(KIO3):n(NaHSO3) =1:1 |
D.②中可能发生了反应:IO +5I-+6H+ = 3I2+3H2O +5I-+6H+ = 3I2+3H2O |
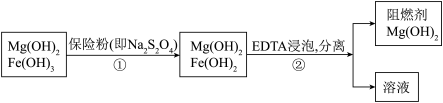
A. 可以作阻燃剂是因为它分解需要吸收大量的热 可以作阻燃剂是因为它分解需要吸收大量的热 |
B.步骤①的反应式为 |
| C.保险粉中含有离子键、极性键、非极性键 |
D. 比 比 更容易和EDTA配合成可溶性化合物 更容易和EDTA配合成可溶性化合物 |

| A.该药物分子中含有27个碳原子 |
| B.该药物能发生酯化反应与水解反应 |
| C.该药物分子中所有碳原子可能在同一平面内 |
| D.该药物分子含有磷酸酰胺键等4种含氧官能团 |
【知识点】 有机官能团的性质及结构 多官能团有机物的结构与性质解读
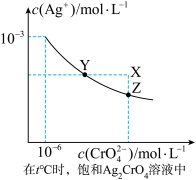
| A.在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCl和0.01  mol/L的K2CrO4的混和溶液,CrO42-先沉淀 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
D.在t℃ 时,反应Ag2CrO4(s)+2Cl-(aq) 时,反应Ag2CrO4(s)+2Cl-(aq)  2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
【知识点】 难溶电解质的溶解平衡 沉淀溶解平衡的应用 溶度积常数相关计算解读
A.在含有大量Fe3+的溶液中:NH 、I-、Na+、SCN- 、I-、Na+、SCN- |
B.水电离出的c(OH-)>10-3 mol·L-1的溶液中:Mg2+、Cl-、NO 、H+ 、H+ |
C.遇石蕊变红的溶液:SO 、NH 、NH 、ClO 、ClO 、K+ 、K+ |
D.与铝反应产生大量氢气的溶液:Ba2+、HCO 、Cl-、Fe2+ 、Cl-、Fe2+ |
【知识点】 离子反应的发生条件解读 离子共存 限定条件下的离子共存解读
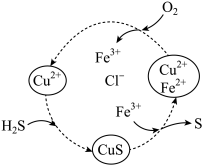
| A.设计循环的目的是降低活化能,减慢总反应速率 |
| B.循环转化过程中有置换反应发生 |
| C.能循环利用的物质只有CuCl2 |
| D.若1mol H2S发生图示转化的同时消耗0.4 molO2,则混合液中Fe3+浓度将减小 |

| A.W与X、W与Z均可形成18电子的分子 |
| B.X、Y可以形成含共价键的离子化合物 |
| C.X、Y、Z三种元素的简单离子半径大小顺序:Z>X>Y |
D.甲的水溶液中:c(W2ZX3) > c(ZX ) ) |

| A.(1)中红色物质中含有Cu或少量Cu2O |
| B.(2)中a电极附近出现浑浊是生成Mg(OH)2所致 |
| C.(3)中的浑浊成分是硫磺 |
| D.(4)中红色褪去是因为NaOH被消耗,溶液不再具有碱性所致 |
【知识点】 电解原理的理解及判断解读
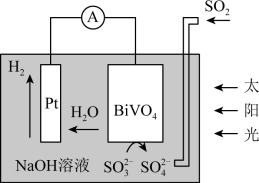
| A.该装置中的能量转化形式:光能→电能→化学能 |
| B.该电化学装置中,Pt电极的电势低于BiVO4电极的电势 |
| C.电子流向:BiVO4电极→H2O→Pt电极→外电路 |
D.BiVO4电极上的反应式为SO -2e-+H2O=SO -2e-+H2O=SO +2H+ +2H+ |
| 容器 | 温度℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| n(A) | n(B) | n(D) | n(D) | ||
| 甲 | 500 | 4.0 | 4.0 | 0 | 3.2 |
| 乙 | 500 | 4.0 | a | 0 | 2.0 |
| 丙 | 600 | 2.0 | 2.0 | 2.0 | 2.8 |
| A.a = 2.2 |
| B.甲容器中反应物的半衰期小于187.5 s |
| C.若容器甲中起始投料减半,则A的平衡转化率相应减小 |
| D.正反应为吸热反应 |
二、解答题 添加题型下试题
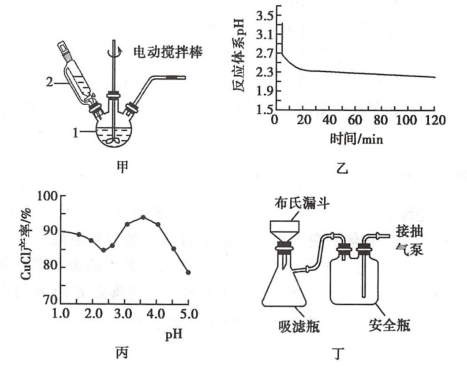
回答以下问题:
(1)制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,CuSO4-NaCl混合液应装在仪器1中,仪器1的名称是
(2)乙图是体系pH随时间变化关系图。写出制备CuCl的离子方程式
(3)丙图是产率随pH变化关系图。实验过程中常用Na2SO3-Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是及时除去生成的H+并维持pH在
(4)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所采用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小。跟常规过滤相比,抽滤的优点是得到的滤饼更干燥,且
(5)工业上常用CuCl作为O2、CO的吸收剂。某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO 2、N2和O2的含量。已知:Na2S2O4和KOH的混合溶液也能吸收氧气。

装置的连接顺序应为
(1)2NO(g)+O2(g)⇌2NO2(g)的反应历程由下列①②两步基元反应组成,相关信息如下:(E为活化能,v为反应速率,k为速率常数)
①2NO(g)
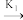 N2O2(g) E正= 82 kJ·mol-1v = klc2(NO)
N2O2(g) E正= 82 kJ·mol-1v = klc2(NO)N2O2(g)
 2NO(g) E逆= 205 kJ·mol-1v = k2c(N2O2)
2NO(g) E逆= 205 kJ·mol-1v = k2c(N2O2)②N2O2(g)+O2(g)
 2NO2(g) E正= 82 kJ·mol-1v= k3c(N2O2)·c(O2)
2NO2(g) E正= 82 kJ·mol-1v= k3c(N2O2)·c(O2)2NO2(g)
 N2O2(g)+O2(g) E逆= 72 KJ·mol-1v = k4c2(NO2)
N2O2(g)+O2(g) E逆= 72 KJ·mol-1v = k4c2(NO2)则:2NO(g)+O2(g)⇌2NO2(g)△H=
(2)2SO2(g)+O2(g)⇌2SO3(g)反应过程中能量变化如图1所示。

①在V2O5存在时,该反应的机理为:
V2O5+ SO2=2VO2+SO3(快)
②下列说法正确的是
a.V2O5的质量或形状不影响反应速率
b.有催化剂存在时∣△H∣<198 kJ·mol-l
c.增大O2的浓度可显著提高反应速率
(3)已知反应NO2(g)+SO2(g)⇌NO(g)+SO3(g)△H <0,某研究小组研究不同温度T1℃、T2℃下的平衡态中lg p(NO2)和lg p(SO3)两个压强对数的关系如图2所示,实验初始时体系中的p( NO2)和p(SO2)相等、p(NO)和p(SO3)相等。
①T1
②同一温度下图象呈线性变化的理由是
已知:i.PbCl2微溶于水
ii.
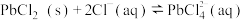 △H>0
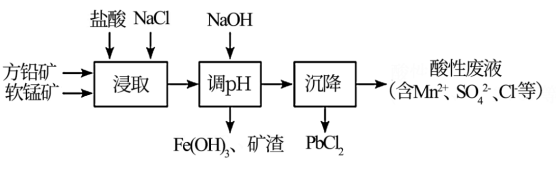
△H>0(1)浸取过程中为提高浸出率,方法除搅拌、粉碎外,还可
 +Mn2++H2O(未配平),则氧化产物的计量系数是
+Mn2++H2O(未配平),则氧化产物的计量系数是(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是
(3)调pH的目的是
(4)沉降池中获得PbCl2采取的两种措施可以是
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:

在
【知识点】 化学反应条件的控制及优化 常见无机物的制备解读 物质制备的探究解读
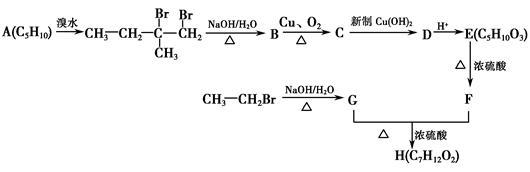
已知:F的核磁共振氢谱有四个峰,峰的面积比为1∶1∶3∶3。
请回答下列问题:
(1)A的名称(系统命名)为
(2)G+F→H的反应类型为
(3)C→D的离子方程式为
(4)E在一定条件下生成的高分子化合物的结构简式为
(5)X是F的同分异构体,它同时符合下列3个条件:①能发生水解反应;②不含甲基;③能发生银镜反应。则X可能的结构简式为
 均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:(1)下列状态的N在跃迁时,用光谱仪可捕捉到发射光谱的是
a.
 b.
b. c.
c.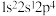 d.
d.
(2)
 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是(3)吡啶为含N有机物,这类物质是合成医药、农药的重要原料。下列吡啶类化合物A与
 (即
(即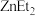 )反应生成有机化合物B,B具有优异的催化性能。
)反应生成有机化合物B,B具有优异的催化性能。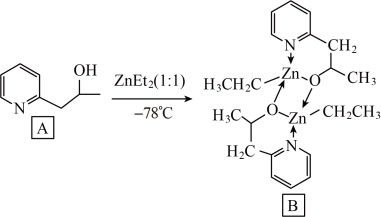
吡啶类化合物A中N原子的杂化类型是
 有机物B的分子结构中含
有机物B的分子结构中含A.离子键 B.配位键 C.
 键 D.
键 D. 键 E.氢键
键 E.氢键(4)N与金属可形成氮化物,如
 的晶体结构如图1所示,某种氮化铁的结构如图2所示。
的晶体结构如图1所示,某种氮化铁的结构如图2所示。
①
 晶体结构单元中,含有的
晶体结构单元中,含有的 、N原子个数均是
、N原子个数均是②若该氮化铁的晶胞边长为
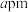 ,阿伏加 德罗常数的值为
,阿伏加 德罗常数的值为 ,则该氮化铁的晶体密度可表示为
,则该氮化铁的晶体密度可表示为 。
。
试卷分析
试卷题型(共 21题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 漂白粉和漂粉精 蛋白质 蛋白质的水解 蛋白质的变性 | |
| 2 | 0.94 | 燃烧热概念 盖斯定律与热化学方程式 | |
| 3 | 0.65 | 化学平衡常数的影响因素及应用 盐的水解常数 | |
| 4 | 0.85 | 化学平衡建立的过程 外界条件对化学平衡影响的图像 与物质百分含量变化有关图像的分析 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 | |
| 6 | 0.65 | 硫酸根离子的检验 卤代烃中卤素原子的检验 淀粉、纤维素的水解 | |
| 7 | 0.65 | 氧化性、还原性强弱的比较 碘与淀粉的显色反应 碘酸钾 亚硫酸及其盐 | |
| 8 | 0.65 | 含镁化合物 氢氧化铁 化学键基本概念 常见无机物的制备 | |
| 9 | 0.85 | 有机官能团的性质及结构 多官能团有机物的结构与性质 | |
| 10 | 0.65 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 溶度积常数相关计算 | |
| 11 | 0.65 | 离子反应的发生条件 离子共存 限定条件下的离子共存 | |
| 12 | 0.65 | 氧化还原反应方程式的配平 基于氧化还原反应守恒规律的计算 活化能及其对反应速率的影响 | |
| 13 | 0.65 | 盐类水解规律 微粒半径大小的比较方法 根据原子结构进行元素种类推断 化学键与物质类别关系的判断 | |
| 14 | 0.65 | 电解原理的理解及判断 | |
| 15 | 0.65 | 原电池原理理解 原电池电子流向判断及应用 原电池正负极判断 原电池电极反应式书写 | |
| 16 | 0.4 | 等效平衡 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | |
| 二、解答题 | |||
| 17 | 0.4 | 常见无机物的制备 物质性质的探究 物质制备的探究 | 实验探究题 |
| 18 | 0.65 | 盖斯定律及其有关计算 活化能及其对反应速率的影响 温度对化学平衡移动的影响 化学平衡常数的有关计算 | 原理综合题 |
| 19 | 0.65 | 化学反应条件的控制及优化 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 20 | 0.65 | 羧酸酯化反应 有机推断综合考查 | 有机推断题 |
| 21 | 0.65 | 物质结构与性质综合考查 电离能 电离能变化规律 晶胞的有关计算 | 结构与性质 |



