名校
1 . 25℃时,用0.10mol/L的氨水滴定10.00mL 0.05mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中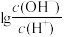 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

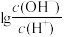 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.H2A的电离方程式为H2A H++HA- H++HA- |
| B.B点溶液中,水电离出的氢离子浓度为1.0×10-6mol/L |
C.C点溶液中,c(NH )+c(NH3·H2O)=2c(A2-) )+c(NH3·H2O)=2c(A2-) |
D.25℃时,该氨水的电离平衡常数为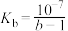 |
您最近一年使用:0次
2018-06-06更新
|
2424次组卷
|
9卷引用:【全国百强校】重庆市第一中学2018-2019学年高二(理)上学期期中考试化学试题
名校
2 . 常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是(已知:CO32-+H2O HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)

 HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)
| A.a点的溶液中:c(HCO3-)> c(H2CO3)+c(CO32-) |
| B.b点横坐标数值大约为10.3 |
| C.c点的溶液中:c(Na+)<2c(CO32-)+c(HCO3-) |
| D.溶液中水的电离程度:a<b<c |
您最近一年使用:0次
2018-05-30更新
|
768次组卷
|
4卷引用:【全国校级联考】重庆市第一中学、合肥八中、石家庄市第一中学2018届高三下学期高考模拟考试理科综合化学试题
【全国校级联考】重庆市第一中学、合肥八中、石家庄市第一中学2018届高三下学期高考模拟考试理科综合化学试题(已下线)2018届高三高考题及模拟题汇编 专题10 水溶液中的离子平衡福建省福州市第三中学2019-2020学年高三10月月考化学试题(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测
名校
3 . 25℃时,不同酸性条件下的0.1mol·L-1HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是


A.随着溶液pH增大, 不断增大 不断增大 |
| B.由水电离出的c(H+):Q>X=Y |
| C.HF的电离常数Ka=1.0×10-3.2 |
| D.0.1mol/LNaF溶液的pH约为8.2 |
您最近一年使用:0次
2018-04-27更新
|
486次组卷
|
4卷引用:【校级联考】重庆市江津中学、合川中学等七校2018-2019学年高二上学期期末考试化学试题
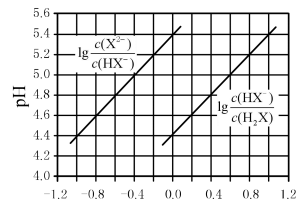
4 . 常温下将NaOH溶液滴加到H2X溶液中,混合溶液的pH与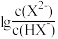 、
、 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
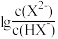 、
、 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
| A.H2X为二元强酸 |
B.当 =1时,溶液中c(HXˉ)=c(H2X) =1时,溶液中c(HXˉ)=c(H2X) |
| C.NaHX溶液中c(H+)<c(OHˉ) |
| D.当溶液pH=4.6时c(HXˉ)>c (X2-) |
您最近一年使用:0次
名校
5 . 常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是


| A.当V( NaOH )= 20mL时,pH<7 |
| B.当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| C.当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)] |
| D.当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-) |
您最近一年使用:0次
2018-04-01更新
|
497次组卷
|
2卷引用:重庆八中2018届高三高考适应性月考(五)理科综合化学试题
名校
6 . 常温下有H2RO4=H++HRO4-、HRO4- H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
 H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是| A.②和③等体积混合后的溶液中: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-) |
| B.100mL①溶液中: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01 |
| C.①和②等体积混合后的溶液中可能的离子浓度为c( HRO4-)>c(H+)>c(Na+) |
| D.若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度 |
您最近一年使用:0次
2018-01-25更新
|
324次组卷
|
2卷引用:重庆市巴蜀中学2018届高三上学期第五次月考理科综合化学试题
7 . 碳及其化合物在工农业上有重要作用。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为_________ (用化学式表示);
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为____________ ;
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如图所示。
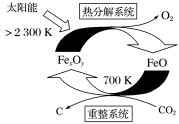
①若“重整系统”发生的反应中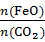 =6,则FexOy的化学式为
=6,则FexOy的化学式为____________ ;
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为____________ 。
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________ (填标号)。
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4mol CO2和8mol H2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=______________ ;KA、KB、KC三者之间的大小关系为_____________ 。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c( )
)________ c( )(填“>”、“<”或“=”);反应
)(填“>”、“<”或“=”);反应 +
+ +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=__________ 。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如图所示。

①若“重整系统”发生的反应中
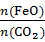 =6,则FexOy的化学式为
=6,则FexOy的化学式为②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4mol CO2和8mol H2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(
 )
) )(填“>”、“<”或“=”);反应
)(填“>”、“<”或“=”);反应 +
+ +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
名校
解题方法
8 . 二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中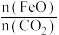 =6,则FexOy的化学式为
=6,则FexOy的化学式为___________ 。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为___________ 。
(2)工业上用CO2和H2反应合成二甲醚。已知:
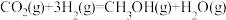

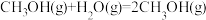
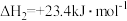
则
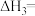
___________  。
。
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是___________ (填代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。
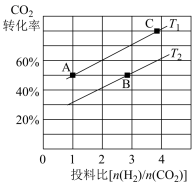
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率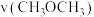 =
=___________ ;KA、KB、KC三者之间的大小关系为___________ 。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c( )
)___________ c( )(填“>”、“<”或“=”);反应
)(填“>”、“<”或“=”);反应 +
+ +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=___________ 。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中
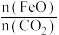 =6,则FexOy的化学式为
=6,则FexOy的化学式为②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为
(2)工业上用CO2和H2反应合成二甲醚。已知:
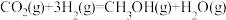

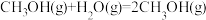
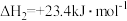
则

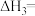
 。
。①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的
 值变小
值变小②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率
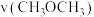 =
=(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(
 )
) )(填“>”、“<”或“=”);反应
)(填“>”、“<”或“=”);反应 +
+ +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2016-12-09更新
|
685次组卷
|
2卷引用:重庆市乌江新高考协作体2023-2024学年高三上学期第一次联合调研抽测(一模)化学试题



