2022高三·全国·专题练习
1 . 甘氨酸 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、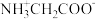 和
和 的分布分数【如
的分布分数【如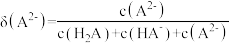 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、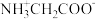 和
和 的分布分数【如
的分布分数【如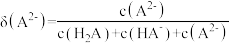 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是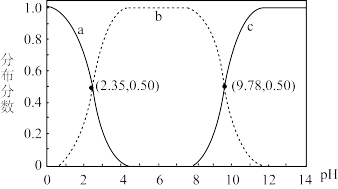
| A.甘氨酸具有两性 |
B.曲线c代表 |
C.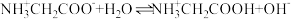 的平衡常数 的平衡常数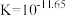 |
D.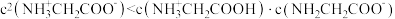 |
您最近一年使用:0次
2022-07-06更新
|
12721次组卷
|
32卷引用:2022年辽宁高考真题化学试题
2022年辽宁高考真题化学试题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第二中学2022-2023学年高三上学期12月考化学试题(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题四 电解质溶液图象(练)(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)江苏省连云港市东海县2022-2023学年高二下学期期中考试化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)微专题(9) 利用图像判断溶液粒子浓度关系(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用(已下线)微专题 水溶液中函数图像的分析第1讲 弱电解质的电离平衡(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖北省沙市中学2023-2024学年高三下学期3月月考化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题
名校
解题方法
2 . 醋酸钠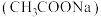 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。
(1)配制 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,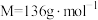 )的质量为
)的质量为_______ 。实验需要的仪器有天平、药匙、玻璃棒、量筒、_______ (从下列图中选择,写出名称)。 水解程度的影响。
水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为 ):
):
i.实验_______ 和_______ (填序号),探究加水稀释对 水解程度的影响;
水解程度的影响;
ii.实验1和3,探究加入 对
对 水解程度的影响;
水解程度的影响;
iii.实验1和4,探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:
_______ 。
②实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据_______ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
③已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测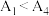 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是_______ 。
(3)小组通过测定不同温度下 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。
查阅资料: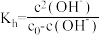 ,
, 为
为 溶液起始浓度。
溶液起始浓度。
试剂: 溶液、
溶液、 盐酸、
盐酸、 计。
计。
实验:测定40℃下 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。
在50℃和60℃下重复上述实验。
数据处理:40℃,
_______ (用含 、
、 、
、 的计算式表示)
的计算式表示)
实验结论: ,温度升高,促进
,温度升高,促进 水解。
水解。
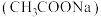 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。(1)配制
 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,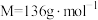 )的质量为
)的质量为
 水解程度的影响。
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
 ):
):i.实验
 水解程度的影响;
水解程度的影响;ii.实验1和3,探究加入
 对
对 水解程度的影响;
水解程度的影响;iii.实验1和4,探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 | 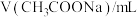 |  | 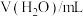 |  |
| 1 | 25℃ | 40.0 | 0 | 0 |  |
| 2 | 25℃ | 4.0 | 0 | 36.0 |  |
| 3 | 25℃ | 20.0 | 10.0 |  |  |
| 4 | 40℃ | 40.0 | 0 | 0 |  |

②实验测得
 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。③已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测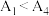 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是(3)小组通过测定不同温度下
 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。查阅资料:
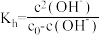 ,
, 为
为 溶液起始浓度。
溶液起始浓度。试剂:
 溶液、
溶液、 盐酸、
盐酸、 计。
计。实验:测定40℃下
 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。| 序号 | 实验 | 记录的数据 |
| 5 | 取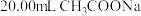 溶液,用 溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 消耗盐酸体积为 |
| 6 | 测40℃纯水的 |  |
| 7 |  |
数据处理:40℃,

 、
、 、
、 的计算式表示)
的计算式表示)实验结论:
 ,温度升高,促进
,温度升高,促进 水解。
水解。
您最近一年使用:0次
2023-03-16更新
|
2404次组卷
|
5卷引用:广东省广州市2023届高三一模考试化学试题
广东省广州市2023届高三一模考试化学试题(已下线)专题19 实验综合题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(实验综合题)广东省广州市2022-2023学年高三普通高中毕业班综合测试(一)化学试题 广东省揭阳华侨高级中学2023-2024学年高三下学期第二次阶段(期中)考试化学试题
3 . 常温下,向一定浓度的NaA溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中 、
、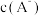 、
、 、
、 的负对数
的负对数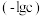 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是

 、
、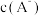 、
、 、
、 的负对数
的负对数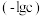 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示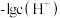 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在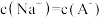 |
C.常温下,将A点对应溶液加水稀释,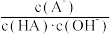 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: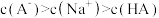 |
您最近一年使用:0次
2022-03-31更新
|
2750次组卷
|
6卷引用:广东省2021-2022学年高三下学期一模化学试题
广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)湖北省2022届高三5月联考化学试题(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题
名校
4 . 已知常温下水溶液中 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中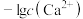 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
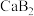 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中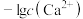 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
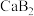 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数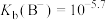 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1860次组卷
|
12卷引用:河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题
河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题重庆市七校2023-2024学年高三上学期开学考试化学试题湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析
5 . 已知:联氨(N2H4)是二元弱碱(pKb1=6,pKb2=15;pK=-lgK),在水中的电离方式类似于氨气,常温下,向0.1mol·L-1N2H5Cl溶液通入HCl或加入NaOH固体(假设溶液总体积不变),溶液中c(N2H )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是

 )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是
A.N2H5Cl溶液c(N2H )>c(N2H4)>c(N2H )>c(N2H4)>c(N2H ) ) |
| B.b点加入NaOH(或HCl)的物质的量与d点加入HCl(或NaOH)物质的量相等 |
| C.水的电离程度:b>a |
D.若c(N2H )>c(N2H4),则pH小于3.5 )>c(N2H4),则pH小于3.5 |
您最近一年使用:0次
2022-03-22更新
|
1387次组卷
|
3卷引用:山东省济南市2022届高三3月高考模拟考试(一模)化学试题
名校
6 . 二元有机酸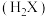 的电离常数
的电离常数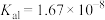 、
、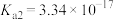 。
。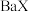 难溶于水,常温下,将
难溶于水,常温下,将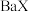 溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与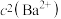 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是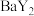 易溶于水。
易溶于水。
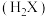 的电离常数
的电离常数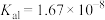 、
、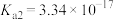 。
。 难溶于水,常温下,将
难溶于水,常温下,将 溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与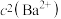 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是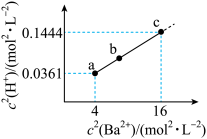
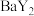 易溶于水。
易溶于水。A.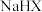 溶液显碱性 溶液显碱性 |
B.溶度积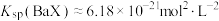 |
C.b点: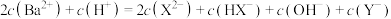 |
D.若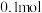 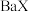 溶于 溶于 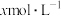 HY溶液中得到氢离子浓度与 HY溶液中得到氢离子浓度与 点相等,则 点相等,则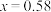 |
您最近一年使用:0次
2023-03-25更新
|
855次组卷
|
2卷引用:辽宁省辽阳市2023届高三一模化学试题
7 . 25℃时,0.10 的
的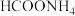 溶液中
溶液中 、
、 、
、 和
和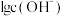 随pH变化(加入HCl或NaOH)的关系如下图所示。下列说法正确的是
随pH变化(加入HCl或NaOH)的关系如下图所示。下列说法正确的是
[已知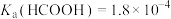 ,
, ]
]

 的
的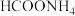 溶液中
溶液中 、
、 、
、 和
和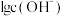 随pH变化(加入HCl或NaOH)的关系如下图所示。下列说法正确的是
随pH变化(加入HCl或NaOH)的关系如下图所示。下列说法正确的是[已知
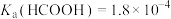 ,
, ]
]
A.原溶液中 |
B.原溶液中 |
C.曲线①表示 随pH的变化 随pH的变化 |
| D.图中M点对应溶液的pH=6.5 |
您最近一年使用:0次
8 . 均苯三甲酸是一种重要的有机三元弱酸,可表示为 。向
。向 的
的 溶液中加入
溶液中加入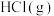 或
或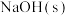 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:
已知:①[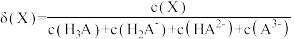 ,X为
,X为 、
、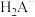 、
、 或
或 ]
]
②(
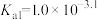 、
、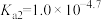 、
、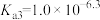 )
)
 。向
。向 的
的 溶液中加入
溶液中加入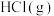 或
或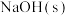 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:已知:①[
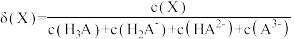 ,X为
,X为 、
、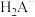 、
、 或
或 ]
]②(

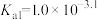 、
、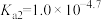 、
、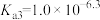 )
)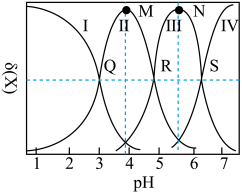
A.若用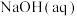 滴定 滴定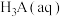 至恰好生成 至恰好生成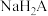 ,可选甲基橙做指示剂 ,可选甲基橙做指示剂 |
B.N点的 |
C.常温下,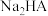 的水解常数 的水解常数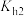 的数量级为 的数量级为 |
D.R点满足: |
您最近一年使用:0次
2022-11-25更新
|
1559次组卷
|
6卷引用:重庆市第一中学校2022-2023学年高二上期期中考试化学试题
9 . 常温下,向20mL1mol·L-1CuCl2溶液中滴加2mol·L-1Na2S溶液的滴定曲线如图所示。已知:pCu=-lgc(Cu2+),lg2.5=0.4,常温下Ksp(FeS)=6.3×10-18;Kal(H2S)=1.2×10-7,Ka2(H2S)=7.1×10-15。下列说法中正确的是
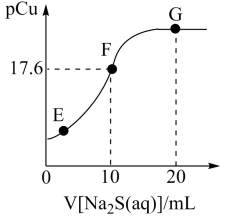

| A.常温下,S2-的水解常数Kh(S2-)约为8.3×10-8 |
| B.E→F→G的过程中,水的电离度一直在减小 |
| C.向1mol·L-1FeSO4(aq)中加入足量CuS固体,产生FeS沉淀 |
| D.25℃时,Cu2++H2S=CuS↓+2H+的K约为1.36×1014 |
您最近一年使用:0次
名校
解题方法
10 . 常温下,向0.1mol•L-1的乙二胺(H2NCH2CH2NH2)溶液中不断通入HCl气体,溶液中三种含氮微粒的物质的量分数δ与pOH的关系图如图。已知:①乙二胺为无色液体,有类似氨的性质,常温下Kb1=10-4.07,Kb2=10-7.15;②假设溶液体积保持不变。下列说法中不正确 的是{已知:pOH=-lgc(OH-)}
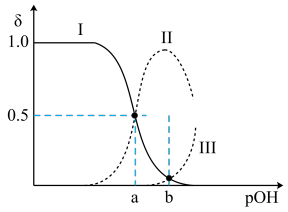

A.曲线Ⅱ代表的微粒符号为H2NCH2CH2NH |
| B.b点的对应pOH=5.61 |
| C.pOH=a时,c(Cl-)>0.05mol•L-1 |
| D.在0.1mol•L-1H2NCH2CH2NH3Cl溶液中:c([H2NCH2CH2NH3]+)>c([H3NCH2CH2NH3]2+)>c(H2NCH2CH2NH2) |
您最近一年使用:0次
2022-10-08更新
|
1170次组卷
|
2卷引用:浙江省浙南名校联盟2022-2023学年高三上学期第一次联考化学试题



