名校
1 . 硫酸铜主要用作纺织品媒染剂、农业杀虫剂等,其晶体(CuSO4·xH2O)在不同温度下会逐步失去结晶水甚至分解。某小组对硫酸铜晶体性质进行探究,回答下列问题:
[探究一]验证硫酸铜晶体的分解产物
某小组同学对某温度下硫酸铜晶体的分解产物进行验证,设计了如下实验:
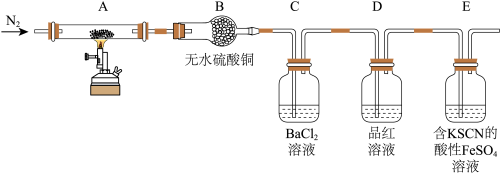
观察到的实验现象有:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中无水硫酸铜变蓝;C中产生白色沉淀;D中品红溶液褪色;E中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为_______ ,C、D两装置位置_______ (填“ 能”或“不能”)交换。
(2)C中产生的沉淀的化学式为_______ ,E中Fe2+发生反应的离子方程式为______ 。
(3)该实验设计的不足之处是_______ 。
[探究二]测定硫酸铜晶体中结晶水含量
实验步骤:①称取mg硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴酸A酸化。
②向①所得溶液中滴加足量BaCl2溶液,得到白色沉淀,将所得沉淀过滤、洗涤。
③将洗涤后的沉淀充分干燥后称得其质量为ag。
(4)步骤①酸A应该选择_______ ( 填“稀盐酸”或者“稀硫酸”),滴加酸A的目的是______ 。
(5)步骤②检验沉淀是否洗涤干净的方法是_______ 。
(6)根据实验数据,硫酸铜晶体( CuSO4·xH2O)中x=_______ (用含 m、a的代数式表示)。
[探究一]验证硫酸铜晶体的分解产物
某小组同学对某温度下硫酸铜晶体的分解产物进行验证,设计了如下实验:

观察到的实验现象有:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中无水硫酸铜变蓝;C中产生白色沉淀;D中品红溶液褪色;E中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为
(2)C中产生的沉淀的化学式为
(3)该实验设计的不足之处是
[探究二]测定硫酸铜晶体中结晶水含量
实验步骤:①称取mg硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴酸A酸化。
②向①所得溶液中滴加足量BaCl2溶液,得到白色沉淀,将所得沉淀过滤、洗涤。
③将洗涤后的沉淀充分干燥后称得其质量为ag。
(4)步骤①酸A应该选择
(5)步骤②检验沉淀是否洗涤干净的方法是
(6)根据实验数据,硫酸铜晶体( CuSO4·xH2O)中x=
您最近一年使用:0次
2023-03-22更新
|
373次组卷
|
3卷引用:四川省凉山彝族自治州2023届高三下学期第二次诊断检测理科综合化学试题
2 . 下列由实验现象所得结论正确的是
A.取补铁口服液的上层清液,滴加酸性 溶液,溶液紫色褪去,证明口服液中含有 溶液,溶液紫色褪去,证明口服液中含有 |
B.向盛有 的 的 溶液的小试管中滴加酚酞溶液,溶液变红,再加入少量 溶液的小试管中滴加酚酞溶液,溶液变红,再加入少量 固体,溶液红色加深,证明 固体,溶液红色加深,证明 水解程度增大 水解程度增大 |
C.向滴有酚酞的NaOH溶液中加入 ,溶液红色褪去,可证明 ,溶液红色褪去,可证明 具有酸性 具有酸性 |
D.向 溶液中通入 溶液中通入 ,再通入X气体,有白色沉淀生成,则X可能为碱性气体 ,再通入X气体,有白色沉淀生成,则X可能为碱性气体 |
您最近一年使用:0次
2022-06-07更新
|
417次组卷
|
3卷引用:山东省德州市2022届高考三模化学试题
名校
3 . 根据下列实验操作和实验现象,得出相应实验结论错误的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向AgCl悬浊液中加入少量KI固体 | 沉淀由白色转化为黄色 | 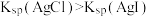 |
| B | 向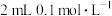 的 的 溶液中加入足量铁粉,振荡,加1滴KSCN溶液 溶液中加入足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: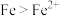 |
| C | 测定饱和 溶液与饱和 溶液与饱和 溶液的pH 溶液的pH | 后者pH更大 |  的水解程度小于 的水解程度小于 |
| D | 向滴有酚酞的 溶液中加入少量 溶液中加入少量 固体 固体 | 生成白色沉淀,且红色逐渐变浅 |  溶液中存在水解平衡 溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-17更新
|
466次组卷
|
2卷引用:山东省济南市2021-2022上学期高二上学期期末考试化学试题
4 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由 水解引起的 水解引起的 |
| B | 室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液、CH3COONa溶液pH | NaClO溶液的pH较大 | 酸性:HClO<CH3COOH |
| C | 向1mL 0.1mol/LNaOH溶液中滴入2滴0.1mol/L MgCl2溶液,再滴入2滴0.1mol/L CuSO4溶液 | 沉淀颜色变化:白色—蓝色 | Ksp:Cu(OH)2<Mg(OH)2 |
| D | 分别向两支试管中加入同浓度、同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色时间不同 | 浓度不同反应速率不同 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-16更新
|
359次组卷
|
2卷引用:福建省厦门第一中学2022-2023学年高三上学期12月月考化学试题
2023高三·全国·专题练习
解题方法
5 .  时,在
时,在 溶液中滴入
溶液中滴入 溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与
溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 时,在
时,在 溶液中滴入
溶液中滴入 溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与
溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A. 的数量级为 的数量级为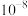 |
B. 时,溶液中主要含磷元素的离子浓度大小关系为 时,溶液中主要含磷元素的离子浓度大小关系为 |
C. 的数量级为 的数量级为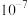 |
D. 溶液显碱性,若向溶液中加入足量的 溶液显碱性,若向溶液中加入足量的 溶液,溶液则显酸性 溶液,溶液则显酸性 |
您最近一年使用:0次
6 . 优化的NaFePO4复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是FeS2,含少量SiO2等杂质)为原料制备NaFePO4的流程如图所示。
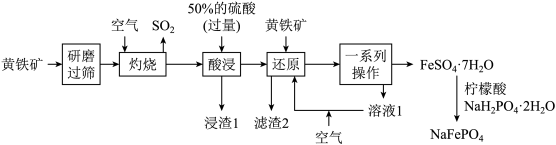
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为_______ (填一种)。
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为_______ (答一条即可)。
(4)“浸渣1”的主要成分是_______ (填化学式) 。
(5)“还原”中FeS2与Fe3+反应的离子方程式为_______ ;通入空气的条件下, “溶液1”可在“还原”步骤中循环利用,则通入空气的目的是_______ 。
(6)“一系列操作”包括_______ 、_______ 、过滤、 洗涤和低温干燥。
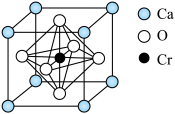
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为_______ ;与Cr最近的氧原子的个数为_______ ;Ca 和Cr的最近距离为a nm,设NA为阿伏加德常数的值,则该晶体密度为_______ (填含 a、NA的表达式)g· cm-3。

已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
| 离子 | Fe2+ | Fe3+ |
| Ksp | 8×10-16 | 4×0-38 |
(1)“研磨”的目的是
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为
(4)“浸渣1”的主要成分是
(5)“还原”中FeS2与Fe3+反应的离子方程式为
(6)“一系列操作”包括
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为

您最近一年使用:0次
7 . 超细碳酸锶是重要的无机化工产品。利用锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3等杂质)制备超细碳酸锶的工艺如下:
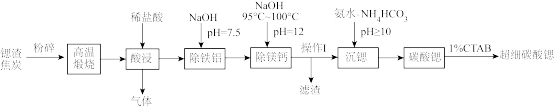
已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4C SrS+4CO↑
SrS+4CO↑
②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
回答下列问题:
(1)“粉碎”的目的是_______
(2)“酸浸”过程中主要反应的化学方程式为_______
(3)“除铁铝”过程中温度控制在75℃左右,适宜的加热方式为_______
(4)“操作I”为_______
(5)①写出“沉锶”的离子方程式_______
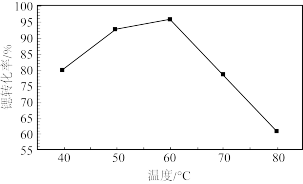
②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为_______ 。
③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因_______ 。

已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4C
 SrS+4CO↑
SrS+4CO↑②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
| 氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
| 氢氧化锶 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
回答下列问题:
(1)“粉碎”的目的是
(2)“酸浸”过程中主要反应的化学方程式为
(3)“除铁铝”过程中温度控制在75℃左右,适宜的加热方式为
(4)“操作I”为
(5)①写出“沉锶”的离子方程式
②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为

③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因
您最近一年使用:0次
2022-04-11更新
|
379次组卷
|
2卷引用:安徽省马鞍山市2022届高三第二次教学质量检测理综化学试题
2021高三·全国·专题练习
8 . 步骤II中,Fe3+的萃取率与pH的关系如图,如pH>1.7后,随pH增大,Fe3+萃取率下降的原因是___________ 。


您最近一年使用:0次
名校
9 . 酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。已知25℃时部分弱电解质的电离常数如下表:
(1)浓度相同的①NaCN② ③
③ 三种溶液,其pH由大到小的顺序为
三种溶液,其pH由大到小的顺序为___________ (填序号)。
(2)在室温下, 醋酸钠溶液的pH约为
醋酸钠溶液的pH约为___________ 。
(3)已知次磷酸 是一种一元弱酸,向10mL
是一种一元弱酸,向10mL 溶液中加入10mL等物质的量浓度的NaOH溶液后,所得溶液中的阴离子有:
溶液中加入10mL等物质的量浓度的NaOH溶液后,所得溶液中的阴离子有:___________ ;常温下, 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
(4)请写出往 溶液中滴加过量HCN溶液反应的离子方程式:
溶液中滴加过量HCN溶液反应的离子方程式:___________ 。
(5)25℃时,氨水与 的混合溶液
的混合溶液 ,该溶液中
,该溶液中
___________ 。
(6)分析化学中,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 作指示剂,利用
作指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。当溶液中的
反应生成砖红色沉淀指示滴定终点。当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中
___________  。(结果保留两位有效数字,已知
。(结果保留两位有效数字,已知 ,
,
 )
)
| 物质 | HCN |  |  |  |  |
| 电离常数 | 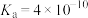 |  |  |  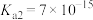 |  |
 ③
③ 三种溶液,其pH由大到小的顺序为
三种溶液,其pH由大到小的顺序为(2)在室温下,
 醋酸钠溶液的pH约为
醋酸钠溶液的pH约为(3)已知次磷酸
 是一种一元弱酸,向10mL
是一种一元弱酸,向10mL 溶液中加入10mL等物质的量浓度的NaOH溶液后,所得溶液中的阴离子有:
溶液中加入10mL等物质的量浓度的NaOH溶液后,所得溶液中的阴离子有: 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是
溶液在加水稀释过程中,下列表达式的数据一定变小的是A.
 B.
B. C.
C. D.
D.
(4)请写出往
 溶液中滴加过量HCN溶液反应的离子方程式:
溶液中滴加过量HCN溶液反应的离子方程式:(5)25℃时,氨水与
 的混合溶液
的混合溶液 ,该溶液中
,该溶液中
(6)分析化学中,以
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 作指示剂,利用
作指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。当溶液中的
反应生成砖红色沉淀指示滴定终点。当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中
 。(结果保留两位有效数字,已知
。(结果保留两位有效数字,已知 ,
,
 )
)
您最近一年使用:0次
名校
解题方法
10 . 下列关于盐类水解的说法正确的是
| A.在Na2S溶液中加入少量Na2S固体,Na2S的水解程度增大 |
| B.将CuSO4溶液由20℃加热到60℃,溶液的pH增大 |
C.向CH3COONa溶液中加水,溶液中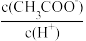 的比值增大 的比值增大 |
| D.常温下,0.1mol/L的NaB溶液的pH=8,溶液中c(Na+)=c(B-)+c(HB)=0.1mol/L |
您最近一年使用:0次



