名校
1 . 下列离子方程式书写正确的是
A. 溶液显碱性的原因: 溶液显碱性的原因: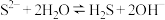 |
B. 的电离方程式: 的电离方程式: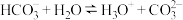 |
C.泡沫灭火器的原理: |
D. 的沉淀溶解平衡: 的沉淀溶解平衡: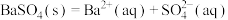 |
您最近一年使用:0次
解题方法
2 . 在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+与CrO 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
(1)溶液中c(Ag+)=_______ 。
(2)溶液中c(CrO )=
)=_______ (写出具体计算过程)。
 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:(1)溶液中c(Ag+)=
(2)溶液中c(CrO
 )=
)=
您最近一年使用:0次
3 . 秦俑彩绘中的铅白(PbCO3)和黄金雨中黄色的PbI2都是难溶的铅盐。室温下,PbCO3和PbI2达到溶解平衡时,-lgc(Pb2+)与-lgc( )或-lgc(I-)的关系如图,下列说法错误的是
)或-lgc(I-)的关系如图,下列说法错误的是
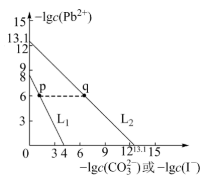
 )或-lgc(I-)的关系如图,下列说法错误的是
)或-lgc(I-)的关系如图,下列说法错误的是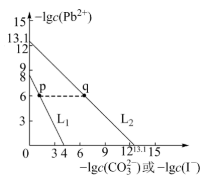
| A.L2曲线代表PbCO3,其Ksp(PbCO3) =1.0×10-13.1 |
| B.p点对应的PbI2溶液中,滴入0.1 mol·L-1 Pb(NO3)2溶液,将析出固体PbI2 |
C.反应PbI2(s)+ (aq) (aq) PbCO3(s)+2I-(aq)的平衡常数K=105.1 PbCO3(s)+2I-(aq)的平衡常数K=105.1 |
| D.向等浓度的Na2CO3与NaI的混合溶液中滴入Pb(NO3)2 溶液先产生黄色沉淀 |
您最近一年使用:0次
2022-09-02更新
|
523次组卷
|
5卷引用:山西省运城市2023-2024学年高二上学期1月期末考试化学试题
山西省运城市2023-2024学年高二上学期1月期末考试化学试题四川省绵阳市2021-2022学年高二下学期期末教学质量测试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省襄阳市第三中学2022-2023学年高二上学期12月月考化学试题四川省泸县第一中学2022-2023学年高二下学期6月期末考试化学试题
解题方法
4 . 25℃时,在c(HR)+c(R-)=0.1mol·L-1的溶液中-lgc(R-)与-lgc(OH-)、难溶盐MR饱和溶液中-lgc(R-)与-lgc(M+)的关系如图所示(忽略离子浓度调节过程中溶液体积变化)。下列说法正确的是
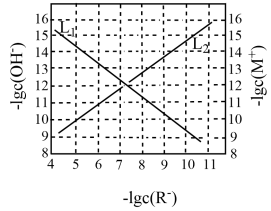

| A.曲线L1表示-lgc(R-)与-lgc(OH-)的关系 |
| B.25℃时,Ksp(MR)的数量级为10-20 |
| C.pH=7时,c(HR)+c(R-)=0.1mol·L-1的溶液中c(HR)<<c(R-) |
| D.加水稀释,两种溶液中的所有离子浓度均减小 |
您最近一年使用:0次
名校
5 . 湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl2-)= ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
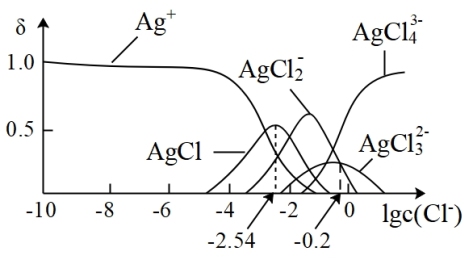
 ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
| A.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol/L |
| B.AgCl溶解程度随c(Cl-)增大而不断减小 |
C.当c(Cl-)=10-2mol·L-1时,溶液中c(AgCl )>c(AgC1 )>c(AgC1 )>c(Ag+) )>c(Ag+) |
D.25℃时,AgCl +Cl- +Cl- AgCl AgCl 的平衡常数K=10-0.2 的平衡常数K=10-0.2 |
您最近一年使用:0次
2022-03-23更新
|
305次组卷
|
22卷引用:山西省运城市2021-2022学年高二上学期期末调研测试化学试题
山西省运城市2021-2022学年高二上学期期末调研测试化学试题四川省宜宾市2021-2022学年高三上学期第一次诊断检测理综化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】16江西省丰城中学2021-2022学年上学期高三创新实验班第四次月考化学试题安徽省六校教育研究会2021-2022学年高三下学期第二次联考理综化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省渭南市2022届高考第一次模拟考试化学试题陕西省渭南市2021-2022学年高三下学期第一次模拟考试化学试题陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题安徽师范大学附属中学2021-2022学年高三上学期第七次测试理综化学试题四川省成都外国语学校2022届高三第二次模拟考试理综化学试题黑龙江省哈尔滨市第六中学2022届高三下学期第一次模拟考试理综化学试题(已下线)押江苏卷第13题 水溶液中的离子平衡 -备战2022年高考化学临考题号押题(江苏卷)山东省潍坊市2022届高三下学期5月模拟考试(一)化学试题(已下线)2022年山东省高考真题变式题(不定项选择题)陕西省西安市长安区2021-2022学年高三上学期期末质量检测化学试题(已下线)学科特色3 电解质溶液图像(已下线)专题12 电解质溶液中的四大平衡常数(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练宁夏回族自治区中卫市2023届高三一模理科综合化学试题四川省成都列五中学2023-2024学年高三上学期阶段性考试(一)理综化学试题四川省泸县第五中学2023-2024学年高三上学期10月月考理综化学试题黑龙江省大庆外国语学校2023-2024学年高二下学期开学质量检测化学试卷
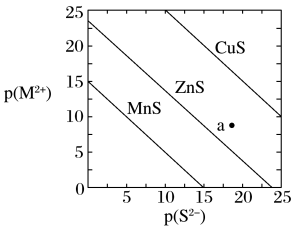
6 . 已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
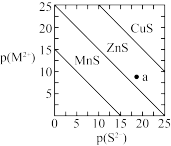

| A.可用CuS除去0.1mol/L的CuCl2溶液中混有的少量MnCl2 |
| B.a点有ZnS沉淀生成 |
| C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)减小 |
D.CuS和MnS共存的悬浊液中,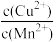 =10-20 =10-20 |
您最近一年使用:0次
解题方法
7 . 下列说法中正确的是
A.向水中加入少量亚硫酸氢钠固体, 减小 减小 |
| B.常温下,将相同体积、pH均为9的烧碱溶液和氨水加水稀释,若两溶液的pH仍相等,则烧碱溶液中加的水少 |
C.常温下,NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO ) ) |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,则Ag+浓度:①>④=②>③ |
您最近一年使用:0次
名校
8 . 已知p(A)=-lgc平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

| A.a点有ZnS沉淀生成 |
| B.可用MnS除去MnCl2溶液中混有的少量ZnCl2 |
| C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c平(S2-)不变 |
D.CuS和MnS共存的悬浊液中,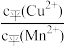 =10-20 =10-20 |
您最近一年使用:0次
2022-01-05更新
|
75次组卷
|
2卷引用:山西省运城市芮城中学2021-2022学年高二上学期12月月考化学试题
解题方法
9 . 已知:25℃时CaCO3的Ksp=2.8×10-9,CaF2的Ksp=2.7×10-11.现将浓度为2×10-4 mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合(忽略混合时溶液体积的变化),下列说法正确的是
| A.CaCO3难溶于稀硫酸,却能溶于醋酸,说明醋酸酸性比硫酸强 |
| B.CaCO3与水形成饱和溶液,再加CaCO3固体,平衡向溶解方向移动,Ksp将增大 |
| C.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合不会析出CaF2固体 |
| D.若要产生沉淀,则所用CaCl2溶液的浓度至少应为5.6×10-5 mol·L-1 |
您最近一年使用:0次
解题方法
10 . 在平衡体系Ca(OH)2(s) Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是
Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是
 Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是
Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是| A.加入少量CuCl2固体 | B.加入少量NaCl固体 |
| C.加入少量K2CO3固体 | D.升高体系温度 |
您最近一年使用:0次
2021-01-25更新
|
200次组卷
|
3卷引用:山西省运城市高中联合体2020-2021学年高二上学期12月阶段性测试化学试题
山西省运城市高中联合体2020-2021学年高二上学期12月阶段性测试化学试题(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)浙江省丽水市高中发展共同体2021-2022学年高二下学期(2月)返校考试化学试题



