名校
1 . I.请回答。
(1)按照有机物的命名规则,下列命名正确的是___________ 。
A.3-乙基己烷 B.2-乙基戊烷, C.1,2-二甲基丁烷 D.4-甲基戊烷
写出该物质的结构简式:___________ 。
Ⅱ.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方让混合气体缓慢反应一段时间。
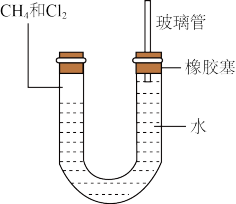
(2)经过几个小时的反应,U形管右端的水面变化是___________ (A升高;B降低;C不变);右端玻璃管的作用是___________ 。
(3)若水中含有Na2SiO3,则在U形管左端会观察到现象是___________ ;若水中含有AgNO3,则水中反应离子方程式___________ 。
(4)若题目中甲烷与氯气的体积比为1:1,则得到的产物为___________(填字母)。
(5)若把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是___________ 。
①黄绿色逐渐消失 ②试管壁上有黄色油珠出现
③水位在试管内上升到一定高度 ④水槽内有少量晶体析出
⑤液面上有白雾
(1)按照有机物的命名规则,下列命名正确的是
A.3-乙基己烷 B.2-乙基戊烷, C.1,2-二甲基丁烷 D.4-甲基戊烷
写出该物质的结构简式:
Ⅱ.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方让混合气体缓慢反应一段时间。

(2)经过几个小时的反应,U形管右端的水面变化是
(3)若水中含有Na2SiO3,则在U形管左端会观察到现象是
(4)若题目中甲烷与氯气的体积比为1:1,则得到的产物为___________(填字母)。
| A.CH3Cl、HCl | B.CCl4、HCl |
| C.CH3Cl、CH2Cl2 | D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl |
(5)若把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是
①黄绿色逐渐消失 ②试管壁上有黄色油珠出现
③水位在试管内上升到一定高度 ④水槽内有少量晶体析出
⑤液面上有白雾
您最近一年使用:0次
名校
2 . 25℃时,用 沉淀
沉淀 、
、 两种金属离子(
两种金属离子( ),所需
),所需 最低浓度的对数值
最低浓度的对数值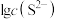 与
与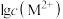 的关系如图所示,请回答:
的关系如图所示,请回答:

(1)25℃时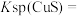
___________ 。
(2)25℃时向50mL的 、
、 浓度均为0.01mol/L的混合溶液中逐滴加入
浓度均为0.01mol/L的混合溶液中逐滴加入 溶液,当
溶液,当 溶液加到150mL时开始生成SnS沉淀,则此时溶液中
溶液加到150mL时开始生成SnS沉淀,则此时溶液中 浓度为
浓度为___________ mol/L。
 沉淀
沉淀 、
、 两种金属离子(
两种金属离子( ),所需
),所需 最低浓度的对数值
最低浓度的对数值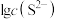 与
与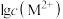 的关系如图所示,请回答:
的关系如图所示,请回答:
(1)25℃时
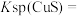
(2)25℃时向50mL的
 、
、 浓度均为0.01mol/L的混合溶液中逐滴加入
浓度均为0.01mol/L的混合溶液中逐滴加入 溶液,当
溶液,当 溶液加到150mL时开始生成SnS沉淀,则此时溶液中
溶液加到150mL时开始生成SnS沉淀,则此时溶液中 浓度为
浓度为
您最近一年使用:0次
名校
3 . 已知25℃时,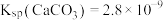 ,
, 式量为100。
式量为100。
(1)书写表示 沉淀溶解平衡的方程式
沉淀溶解平衡的方程式___________ 。
(2)计算25℃ 的溶解度
的溶解度___________  水。(保留2位有效数字)
水。(保留2位有效数字)
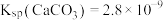 ,
, 式量为100。
式量为100。(1)书写表示
 沉淀溶解平衡的方程式
沉淀溶解平衡的方程式(2)计算25℃
 的溶解度
的溶解度 水。(保留2位有效数字)
水。(保留2位有效数字)
您最近一年使用:0次
4 . T1、T2两种温度下 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
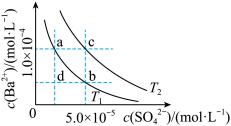
(1)T1___________ T2 (填“>”“<”或“=”),T2温度时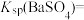
___________ 。
(2)根据T1温度时 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是___________ (填序号)。
A.加入 固体可由a点变为b点
固体可由a点变为b点
B.T1温度下,在T1曲线上方区域(不含曲线)的任意一点时,均有 沉淀生成
沉淀生成
C.蒸发溶剂可能由d点变为T1,曲线上a、b之间(不含a、b)的某一点
D.升温可由b点变为d点
(3) T2温度时,现有0.2mol的 沉淀,每次用1 L饱和
沉淀,每次用1 L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理___________ 次[提示: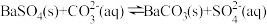
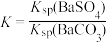 ,
,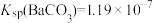 ]。
]。
 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
(1)T1
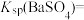
(2)根据T1温度时
 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是A.加入
 固体可由a点变为b点
固体可由a点变为b点B.T1温度下,在T1曲线上方区域(不含曲线)的任意一点时,均有
 沉淀生成
沉淀生成C.蒸发溶剂可能由d点变为T1,曲线上a、b之间(不含a、b)的某一点
D.升温可由b点变为d点
(3) T2温度时,现有0.2mol的
 沉淀,每次用1 L饱和
沉淀,每次用1 L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理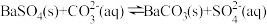
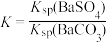 ,
,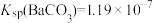 ]。
]。
您最近一年使用:0次
2021-08-07更新
|
1011次组卷
|
12卷引用:上海市向明中学 2023-2024学年高三上学期9月质量监控化学试题
上海市向明中学 2023-2024学年高三上学期9月质量监控化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时2 Ksp图象及其相关计算高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时2 Ksp图像及其相关计算(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)3.4.2沉淀溶解平衡原理的应用 课中微专题(11) 沉淀溶解平衡图像分析
2012·上海奉贤·二模
5 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
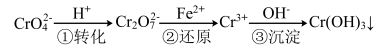
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显____________ 色.
(2)能说明第①步反应达平衡状态的是_____________ 。
a Cr2O72-和CrO42-的浓度相同 b 2v(Cr2O72-)=v(CrO42-)
c 溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要________ mol的FeSO4·7H2O。
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2-(亮绿色)+H2O Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色)+ 3OH-
Cr3+(紫色)+ 3OH-
下列有关说法中正确的是_______
a 加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b 在一定条件下存在:Cr(OH)3+OH-=CrO2-+2H2O;Cr(OH)3+3H+=Cr3++3H2O
c Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d Cr(OH)3(固)在水中的存在叁个平衡

其中第①步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a Cr2O72-和CrO42-的浓度相同 b 2v(Cr2O72-)=v(CrO42-)
c 溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2-(亮绿色)+H2O
 Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色)+ 3OH-
Cr3+(紫色)+ 3OH-下列有关说法中正确的是
a 加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b 在一定条件下存在:Cr(OH)3+OH-=CrO2-+2H2O;Cr(OH)3+3H+=Cr3++3H2O
c Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d Cr(OH)3(固)在水中的存在叁个平衡
您最近一年使用:0次
名校
解题方法
6 . 现有25℃时0.1mol•L-1的氨水,请回答以下问题:
(1)氨水呈碱性的原因为(用离子方程式表示)___ 。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式___ ;若所得溶液的pH=5,则溶液中水所电离出的氢离子浓度为___ 。
(3)若向氨水中加入少量硫酸铵固体,此时溶液中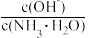
__ (填“增大”、“减小”或“不变”)。
(4)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol•L-1,则c(SO42-)=__ 。
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___ 。
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,无现象,若继续加入氨水,产生白色沉淀,用电离平衡解释原因___ 。
(1)氨水呈碱性的原因为(用离子方程式表示)
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式
(3)若向氨水中加入少量硫酸铵固体,此时溶液中
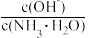
(4)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol•L-1,则c(SO42-)=
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,无现象,若继续加入氨水,产生白色沉淀,用电离平衡解释原因
您最近一年使用:0次
名校
7 . 向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象。_______________________________
您最近一年使用:0次
2019-12-22更新
|
99次组卷
|
2卷引用:【全国百强校】上海市复旦大学附属中学2019—2020学年高三上学期期中考试化学试题
名校
8 . CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)设计简单实验证明CH3COOH为弱酸__ 。
(2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,在稀释过程中,下列量的变化是(“增大”、“减小”、“不变”或“不能确定”):
n(H+)=___ , =
=___ , =
=__ ,c(OH-)=___ 。
(3)OH-浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是__ (填写序号)
①反应需要的时间:CH3COOH>HCl
②开始反应的速率:HCl>CH3COOH
③参加反应的锌粉的物质的量:CH3COOH=HCl
④反应过程的平均速率:CH3COOH>HCl
⑤盐酸中有锌粉剩余
⑥CH3COOH溶液中有锌粉剩余
(4)向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是__ 。
A.白色沉淀 B.液体分层 C.无明显现象 D.黄绿色气体
(5)现有下列溶液:①纯水;②pH=10的NaOH溶液;③pH=3的醋酸溶液;④pH=10的CH3COONa溶液。试比较四种溶液中水的电离程度的大小关系__ 。
(1)设计简单实验证明CH3COOH为弱酸
(2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,在稀释过程中,下列量的变化是(“增大”、“减小”、“不变”或“不能确定”):
n(H+)=
 =
= =
=(3)OH-浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
①反应需要的时间:CH3COOH>HCl
②开始反应的速率:HCl>CH3COOH
③参加反应的锌粉的物质的量:CH3COOH=HCl
④反应过程的平均速率:CH3COOH>HCl
⑤盐酸中有锌粉剩余
⑥CH3COOH溶液中有锌粉剩余
(4)向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是
A.白色沉淀 B.液体分层 C.无明显现象 D.黄绿色气体
(5)现有下列溶液:①纯水;②pH=10的NaOH溶液;③pH=3的醋酸溶液;④pH=10的CH3COONa溶液。试比较四种溶液中水的电离程度的大小关系
您最近一年使用:0次
9 . 请回答:
(1)写出CH3Cl的电子式____ 。
(2)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下10g甲硅烷自燃放出热量473.5kJ,其热化学方程式是____ 。
(3)工业废水中加入难溶于水的FeS使其中的Cu2+离子转化为沉淀,写出该反应的离子方程式___ 。
(4)碱性条件下发生下列反应,配平该反应的离子方程式:__ ClO3﹣+__ Fe3++__ =__ Cl﹣+__ FeO42﹣+__ 。
(1)写出CH3Cl的电子式
(2)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下10g甲硅烷自燃放出热量473.5kJ,其热化学方程式是
(3)工业废水中加入难溶于水的FeS使其中的Cu2+离子转化为沉淀,写出该反应的离子方程式
(4)碱性条件下发生下列反应,配平该反应的离子方程式:
您最近一年使用:0次



