名校
解题方法
1 . 废旧铅蓄电池会导致铅污染,回收铅的流程如图所示。
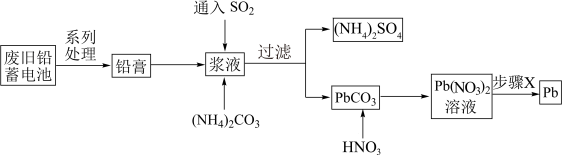
| A.SO2的作用是将PbO2还原成PbSO4 |
B.加入(NH4)2CO3后发生的反应为:PbSO4(s)+CO (aq) (aq) PbCO3(s)+SO PbCO3(s)+SO (aq) (aq) |
| C.步骤X可以是蒸干灼烧 |
| D.若步骤X为电解,则整个流程中,HNO3可循环使用 |
您最近一年使用:0次
2023-09-17更新
|
669次组卷
|
7卷引用:2024届南昌市第十九中学高三下学期模拟预测化学试题
名校
解题方法
2 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
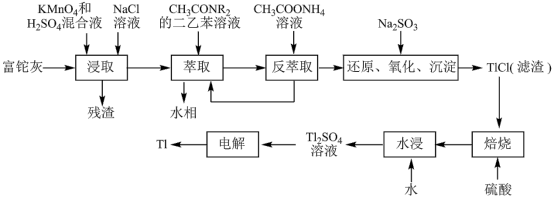
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
772次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题
名校
解题方法
3 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 向溶液X中滴加浓盐酸,将产生气体通入品红溶液,溶液褪色 | 证明溶液X中含有 或 或 |
| B | 室温下,向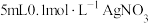 溶液中加入几滴 溶液中加入几滴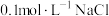 溶液出现白色沉淀,再滴加几滴 溶液出现白色沉淀,再滴加几滴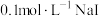 溶液,出现黄色沉淀 溶液,出现黄色沉淀 | 证明相同温度下: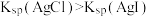 |
| C | 常温下,测得相同浓度溶液的 : : | 证明常温下的水解程度: |
| D | 将 溶液滴入酸性 溶液滴入酸性 溶液中,紫红色褪去 溶液中,紫红色褪去 | 证明 有还原性 有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-02更新
|
1380次组卷
|
4卷引用:江西省新余市2022-2023学年高二上学期期末质量检测化学试题
10-11高二下·浙江杭州·期中
名校
解题方法
4 . 下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[ 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒
③石灰岩(喀斯特地貌)溶洞的形成
④ 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以
⑤泡沫灭火器灭火原理
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[
 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒 ③石灰岩(喀斯特地貌)溶洞的形成
④
 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以 ⑤泡沫灭火器灭火原理
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
您最近一年使用:0次
2022-04-06更新
|
1320次组卷
|
55卷引用:江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题
江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷河北省衡水中学2016-2017学年高一下学期三调考试化学试题吉林省延边第二中学2017-2018学年高二上学期第二次月考化学试题2017-2018学年四川省乐山四校高二第二学期半期联考化学试题【全国百强校】河北省辛集中学2018-2019学年高二上学期期中考试化学试题(已下线)2019年1月7日 《每日一题》人教选修4-沉淀的生成与溶解【全国百强校】河北省冀州市中学2018-2019学年高二上学期第五次月考化学试题2019年10月20日《每日一题》2020年高考化学一轮复习—— 每周一测黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题北京市2019—2020学年高二上学期期中考试化学试题(选修4人教版)苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡湖南省常德市淮阳中学2019-2020学年高二下学期期中考试化学试题(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡原理的应用(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖北省武汉市钢城四中2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测选择性必修1(SJ)专题3第四单元 沉淀溶解平衡课时1 沉淀溶解平衡及其应用(已下线)专题3.4.2 沉淀溶解平衡的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)北京市首都师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省哈尔滨市第一六二中学2021-2022学年高二上学期期末考试化学试题(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题江苏省天一中学2021-2022学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第26讲 难溶电解质的溶解平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省黄陵中学2021-2022学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山西省太原师范学院附属中学2022-2023学年高二上学期12月月考化学试题山东省淄博市桓台第二中学2021-2022学年高一9月月考化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第52练 难溶电解质的溶解平衡3.4.1沉淀溶解平衡原理 课后(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)作业(二十一) 沉淀溶解平衡的应用
5 . 天然水体中的H2CO3与空气中的(CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9,某溶洞水体中lgc(X)(X为H2CO3、 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是

 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是
A.曲线①代表 |
| B.H2CO3的一级电离常数为10-8.3 |
| C.c(Ca2+)随pH升高而增大 |
| D.pH=10.3时,c(Ca2+)=2.8×10-7.9mol·L-1 |
您最近一年使用:0次
2022-12-04更新
|
1398次组卷
|
22卷引用:江西省抚州市临川第一中学2022届高三下学期4月模拟考试理科综合化学试题
江西省抚州市临川第一中学2022届高三下学期4月模拟考试理科综合化学试题辽宁省2021年普通高中学业水平选择考适应性测试化学试题(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(新高考)四川省射洪市2021届高考考前模拟测试理综化学试题选择性必修1(SJ)专题3专项拓展训练 水溶液中离子平衡图象分析安徽省示范高中培优联盟20212022学年高二上学期冬季联赛化学试题江苏省南京师范大学附属中学2021-2022学年高三下学期开学考试化学试题 湖南省怀化市通道县第一中学2021-2022学年高三下学期4月月考化学试题第三章水溶液中的离子反应与平衡福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第54讲 水溶液中四大平衡常数的综合应用(已下线)易错点3不会利用“特殊点”解电解质溶液图像题(已下线)题型141 Ksp的相关计算(已下线)T15-溶液中的离子平衡(已下线)第5讲 难溶电解质的溶解平衡黑龙江省哈尔滨市第一中学校2022-2023学年高三上学期12月月考化学试题辽宁师范大学附属中学2021-2022学年高三上学期阶段测试化学试题重庆市第一中学校2023-2024学年高二上学期第一次月考化学试题(已下线)选择题11-15湖南省邵阳市邵东市创新高级中学2023-2024学年高二上学期创高杯考试化学试题
名校
6 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
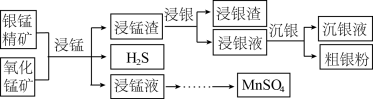
已知:Ⅰ.酸性条件下, 的氧化性强于
的氧化性强于 ;
;
Ⅱ.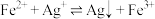 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:________ 。
②“浸锰”过程中,发生反应: ,则可推断:
,则可推断: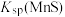
________ (填“>”或“<”)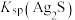 。
。
③在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有________ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_____ 。
________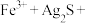 ________
________ ________
________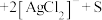
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:________ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有 和
和________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:________ 。
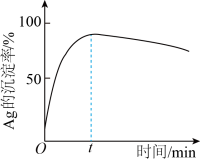
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下,
 的氧化性强于
的氧化性强于 ;
;Ⅱ.
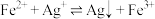 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①写出Mn元素基态原子的价层电子排布式:
②“浸锰”过程中,发生反应:
 ,则可推断:
,则可推断: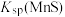
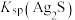 。
。③在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
________
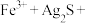 ________
________ ________
________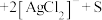
②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
 和
和②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
2023-07-19更新
|
625次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
7 . 已知:室温下氢硫酸 的电离常数
的电离常数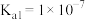 ,
,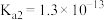 ;
; 和
和 的
的 分别为
分别为 、
、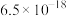 ,下列说法不正确的是
,下列说法不正确的是
 的电离常数
的电离常数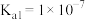 ,
,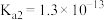 ;
; 和
和 的
的 分别为
分别为 、
、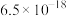 ,下列说法不正确的是
,下列说法不正确的是A.反应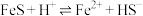 的平衡常数 的平衡常数 的数值为 的数值为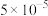 |
B.可以用 除去污水中的 除去污水中的 |
C.从上述数据可得出 难溶于稀硫酸中 难溶于稀硫酸中 |
D. 的 的 溶液中加入等体积 溶液中加入等体积 的 的 溶液,则有: 溶液,则有: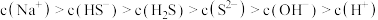 |
您最近一年使用:0次
2023-05-06更新
|
656次组卷
|
3卷引用:江西省鹰潭市余江区第一中学2023-2024学年高三下学期二模考试化学试题
8 . 常温下,向10.0mL浓度均为0.1mol/L的 和
和 混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.
混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.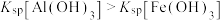 ;
;
②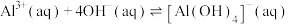 ,298K,
,298K, 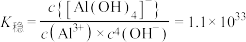 。
。
下列叙述正确的是
 和
和 混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.
混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.
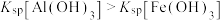 ;
;②
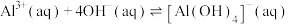 ,298K,
,298K, 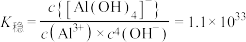 。
。下列叙述正确的是
A.曲线Ⅱ代表 |
B.常温下,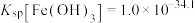 |
C.c点铁铝元素主要存在形式为 和 和 |
D.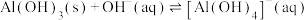 的平衡常数K为 的平衡常数K为 数量级 数量级 |
您最近一年使用:0次
2023-11-29更新
|
576次组卷
|
3卷引用:江西师范大学附属中学2023-2024学年高三上学期期中考试化学试题
9 . 向10mL浓度均为0.1mol·L-1的FeSO4和ZnSO4的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水(K b=1.8×10-5)体积关系如图所示,测得M、N点溶液pH分别为8.04、8.95。 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06
ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是
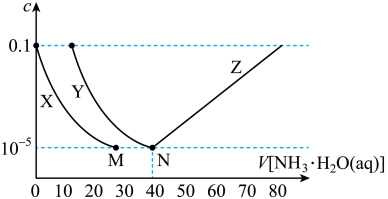
 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是
| A.曲线X表示Zn2+ |
| B.Ksp[Fe(OH)2]=10-15.1 |
| C.N点锌元素的主要存在形式是[Zn(NH3)4]2+ |
D.Zn(OH)2+4NH3 [Zn(NH3)4]2++2OH- K=10-7.86 [Zn(NH3)4]2++2OH- K=10-7.86 |
您最近一年使用:0次
2022-11-18更新
|
1228次组卷
|
6卷引用:江西省宜春市九校2023届高三下学期第二次联考理科综合化学试题
名校
解题方法
10 . 碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分Cu2Te,还有少量的Ag、Cu)中提取碲的流程如图:

回答下列问题:
(1)写出碲元素在元素周期表中的位置____ 。
(2)“酸浸”过程中生成TeOSO4的离子方程式为____ 。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明____ 。
(4)电解除铜时,铜、碲沉淀的关系如表。
①电解初始阶段阴极的电极反应式是____ 。
②最佳电解时间为30min,原因是____ 。
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式____ ,其中Te元素的回收率为____ (忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。
(6)整个过程中可循环利用的物质为____ (填化学式)。

回答下列问题:
(1)写出碲元素在元素周期表中的位置
(2)“酸浸”过程中生成TeOSO4的离子方程式为
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明
(4)电解除铜时,铜、碲沉淀的关系如表。
| 电解时间(min) | 铜沉淀率 | 碲沉淀率 |
| 10 | 25% | 0.1% |
| 20 | 40% | 0.2% |
| 30 | 62% | 0.4% |
| 40 | 65% | 2.0% |
②最佳电解时间为30min,原因是
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式
(6)整个过程中可循环利用的物质为
您最近一年使用:0次
2022-05-05更新
|
679次组卷
|
3卷引用:江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题
江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题



