解题方法
1 . Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为_______ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将_______ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是_______ ,上述四种离子浓度的大小顺序为_______ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为_______ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______ c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入_______(填字母序号),沉淀效果最好。
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______ 。
Cr2O
 +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、NH
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(NH
 )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(NH
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
您最近一年使用:0次
2 . 中国人从月球“挖”来“嫦娥石”,“嫦娥石”如图所示。它的主要成分是磷酸盐。 (磷灰石)是磷酸盐之一。磷灰石在水中存在平衡:
(磷灰石)是磷酸盐之一。磷灰石在水中存在平衡: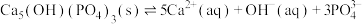
 ,常温下,磷灰石的溶度积
,常温下,磷灰石的溶度积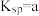 。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。
。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。
下列有关W的叙述错误的是
 (磷灰石)是磷酸盐之一。磷灰石在水中存在平衡:
(磷灰石)是磷酸盐之一。磷灰石在水中存在平衡: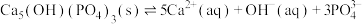
 ,常温下,磷灰石的溶度积
,常温下,磷灰石的溶度积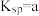 。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。
。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。
下列有关W的叙述错误的是
A.加入少量盐酸, 减小 减小 | B.加入少量蒸馏水,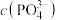 减小 减小 |
C.W中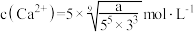 | D.对W加热,磷灰石的溶解度和 都会增大 都会增大 |
您最近一年使用:0次
名校
解题方法
3 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 比较CH3COO−和HCO 的水解常数 的水解常数 | 分别测定浓度均为0.1mol·L−1的CH3COONH4和NaHCO3溶液的pH,后者大于前者 | Kh(CH3COO−)<Kh(HCO ) ) |
| B | 探究Fe3+、Cu2+对H2O2分解的催化作用 | 在a、b两支试管中分别加入2mL5% H2O2溶液,分别滴入0.2mol·L−1FeCl3溶液、0.3mol·L−1CuCl2溶液各0.5mL,a中冒出气泡速率比b快 | 催化作用:Fe3+>Cu2+ |
| C | 比较AgCl、AgI的溶度积 | 在含0.1mol的AgNO3溶液中依次加入NaCl溶液和NaI溶液,先有白色沉淀生成,后来又变成黄色 | Ksp(AgCl)>Ksp(AgI) |
| D | 验证Al、Cu的活泼性 | 将相同大小的铜片、铝片用导线连接,平行放入浓硝酸中,铜片不断溶解 | 活泼性:Al<Cu |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-13更新
|
203次组卷
|
3卷引用:江西省宜春市丰城市第九中学2023-2024学年高二下学期4月期中考试化学试题
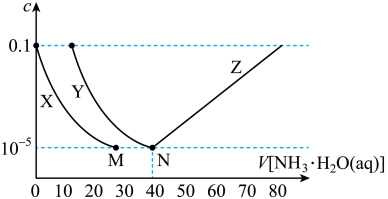
4 . 常温下,难溶物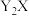 与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,
与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,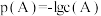 ,
, 表示
表示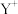 或
或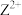 。下列说法错误的是
。下列说法错误的是
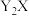 与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,
与ZX在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示,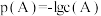 ,
, 表示
表示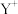 或
或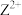 。下列说法错误的是
。下列说法错误的是
A.N表示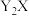 的溶解平衡曲线 的溶解平衡曲线 |
B.常温下,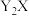 的分散系在c点时为悬浊液 的分散系在c点时为悬浊液 |
C.向b点溶液中加入 饱和溶液,析出ZX固体 饱和溶液,析出ZX固体 |
D.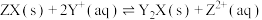 的平衡常数 的平衡常数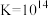 |
您最近一年使用:0次
2022-12-06更新
|
127次组卷
|
2卷引用:江西省丰城中学2022-2023学年高二下学期开学考试化学试题
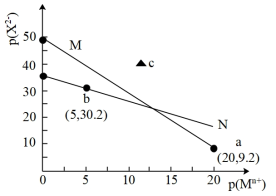
5 . 向10mL浓度均为0.1mol·L-1的FeSO4和ZnSO4的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水(K b=1.8×10-5)体积关系如图所示,测得M、N点溶液pH分别为8.04、8.95。
已知:i.Zn2++4NH3 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06
ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是

已知:i.Zn2++4NH3
 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是
| A.曲线X表示Zn2+ |
| B.Ksp[Fe(OH)2]=10-15.1 |
| C.N点锌元素的主要存在形式是[Zn(NH3)4]2+ |
D.Zn(OH)2+4NH3 [Zn(NH3)4]2++2OH- K=10-7.86 [Zn(NH3)4]2++2OH- K=10-7.86 |
您最近一年使用:0次
2022-11-18更新
|
1216次组卷
|
5卷引用:江西省宜春市九校2023届高三下学期第二次联考理科综合化学试题
名校
6 . 25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是


A.a点溶液满足:c(NH )>c(NH3·H2O)>c(Mg2+)>c(OH-) )>c(NH3·H2O)>c(Mg2+)>c(OH-) |
| B.b点溶液中无Mg(OH)2沉淀产生 |
C.c点溶液满足:2c(Mg2+)+c( )>c(Cl-) )>c(Cl-) |
| D.Ksp[Mg(OH)2]的数量级是10-12 |
您最近一年使用:0次
2022-10-27更新
|
427次组卷
|
3卷引用:江西省宜春市第一中学2022-2023学年高二上学期期末考试化学试题
名校
7 . 含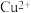 的废水常用
的废水常用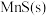 作沉淀剂,原理为
作沉淀剂,原理为 。一定温度下,下列有关该反应的推理正确的是
。一定温度下,下列有关该反应的推理正确的是
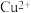 的废水常用
的废水常用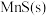 作沉淀剂,原理为
作沉淀剂,原理为 。一定温度下,下列有关该反应的推理正确的是
。一定温度下,下列有关该反应的推理正确的是A.该反应达到平衡时,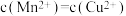 |
B.平衡体系中加入少量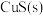 后, 后,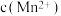 变小 变小 |
C.平衡体系中加入少量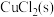 后, 后,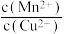 变大 变大 |
D.该反应平衡常数: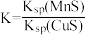 |
您最近一年使用:0次
2022-10-13更新
|
447次组卷
|
3卷引用:江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2022-2023学年高三上学期11月期中考试化学试题浙江省10校联盟2022-2023学年高三上学期10月月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题16-20)
8 . NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
(1)向滤液Ⅰ中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为___________ ,当c(Cu2+)≤1.0×10-5mol•L-1时,可认为Cu2+已沉淀完全,此时溶液中S2-的浓度不小于___________ 。(已知:Ksp(CuS)=6.3×10-36)
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是___________ 。
②调节滤液Ⅱ的pH,pH应控制在范围___________ 。
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是___________ 。
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___________ 。

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 2.2 | 3.2 |
| Ni2+ | 6.4 | 8.4 |
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是
②调节滤液Ⅱ的pH,pH应控制在范围
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2022-09-26更新
|
251次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题
9 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
 | 向苯酚浊液中加入 溶液,溶液变澄清 溶液,溶液变澄清 | 酸性:苯酚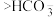 |
 | 无水乙醇与浓硫酸共热至 ,将产生的气体通入溴水中,溴水褪色 ,将产生的气体通入溴水中,溴水褪色 | 乙烯和溴水发生加成反应 |
 | 氯乙烷与 溶液共热后,滴加 溶液共热后,滴加 溶液,生成白色沉淀 溶液,生成白色沉淀 | 氯乙烷已发生水解 |
 | 在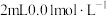 的 的 溶液中先滴入几滴 溶液中先滴入几滴  溶液有白色沉淀生成,再滴入 溶液有白色沉淀生成,再滴入  溶液,又出现黑色沉淀 溶液,又出现黑色沉淀 | 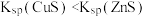 |
A. | B. | C. | D. |
您最近一年使用:0次
10 . 化学与人类生产、生活、可持续发展密切相关。下列说法不正确的是
| A.乙烯的产量是衡量国家石油化工发展水平的重要标志 |
| B.用明矾代替二氧化氯处理生活污水,可提高杀菌消毒效果 |
| C.牙膏中添加氟化物用于预防龋齿 |
| D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
您最近一年使用:0次
2022-06-01更新
|
100次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题



