名校
解题方法
1 . 高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含金属单质 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
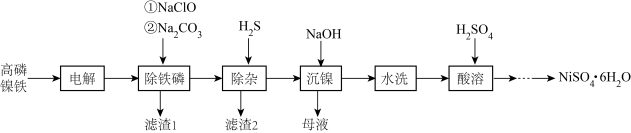
(1)“电解”时,选用 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作___________ (填“阳极”或“阴极”);另一极的主要电极反应为:_____________________ 。此外,溶液中的 有部分在阴极放电。
有部分在阴极放电。
(2)“沉镍”时,离子方程式为___________________________________________ ,为确保镍沉淀完全,理论上应调节溶液
_____________ (已知:在该工业环境下, ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)已知: 时,
时, 、
、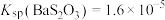 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为________ 。
(4)从 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:___________ 、__________ 、过滤、洗涤、干燥。
 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
(1)“电解”时,选用
 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作 有部分在阴极放电。
有部分在阴极放电。(2)“沉镍”时,离子方程式为

 ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)已知:
 时,
时, 、
、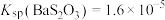 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为(4)从
 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:
您最近一年使用:0次
2024-03-01更新
|
109次组卷
|
2卷引用:江西省新余市第一中学2023-2024学年高二下学期开学考试化学试题
2 .  是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
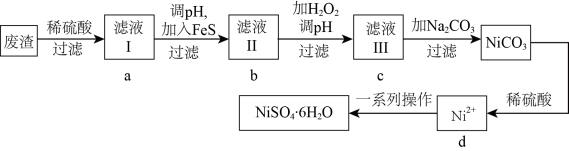
已知:各离子开始沉淀及完全沉淀时的 如表所示:
如表所示:
根据要求回答下列问题
(1)基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有______________ 种,画出基态原子的价电子轨道表示式______________ 。
(2)向滤液Ⅰ中加入 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为_______________________________________ ,当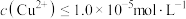 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于_____________ 。[已知: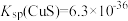 ]
]
(3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因__________________________ ;
②调节滤液Ⅱ的 ,
, 应控制在范围为
应控制在范围为__________________________ ;
③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是_______________________________________ 。
(4)滤液Ⅲ溶质的主要成分是 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是_______________________________________ 。
 是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的
 如表所示:
如表所示:离子 | 开始沉淀时的 | 完全沉淀时的 |
| 6.3 | 9.7 |
| 2.2 | 3.2 |
| 6.4 | 8.4 |
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)向滤液Ⅰ中加入
 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为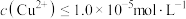 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于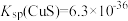 ]
](3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加
 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因②调节滤液Ⅱ的
 ,
, 应控制在范围为
应控制在范围为③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是
(4)滤液Ⅲ溶质的主要成分是
 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是
您最近一年使用:0次
名校
解题方法
3 . 化学与生产、生活息息相关。下列说法正确的是
| A.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
| B.在铁制品上镀铜时,铁制品所在电极发生氧化反应 |
C.在去除锅炉水垢中的 时,通常先用碳酸钠溶液浸泡,再用酸去除 时,通常先用碳酸钠溶液浸泡,再用酸去除 |
| D.用氯气和氢氧化钠制取消毒液,运用了盐类水解的原理 |
您最近一年使用:0次
2024-01-26更新
|
82次组卷
|
2卷引用:江西省新余市第一中学2023-2024学年高二下学期开学考试化学试题
4 . 根据下列图示所得出的结论正确的是
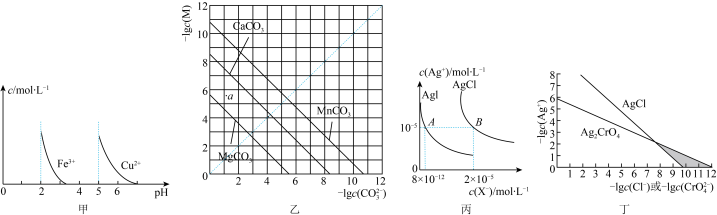

| A.由图甲可知,除去CuSO4溶液中的Fe3+可加入适量NaOH溶液调节pH至4左右 |
B.图乙是一定温度下三种碳酸盐的沉淀溶解平衡曲线,a点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO ) ) |
| C.图丙是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,该温度下反应AgCl(s)+I-(aq)⇌AgI(s)+Cl-(aq)的平衡常数K=2.5×106 |
| D.图丁是室温下AgCl和Ag2CrO4的沉淀溶解平衡曲线,阴影区域中的点可以同时生成Ag2CrO4沉淀和AgCl沉淀 |
您最近一年使用:0次
2022-11-26更新
|
397次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
名校
解题方法
5 . 根据下列实验操作和实验现象,得出的实验结论正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 常温下,分别测定0.01mol/L的NaHSO3溶液和0.01mol/L的NaHCO3溶液的pH值 | NaHCO3的pH值大 | 非金属性:S>C |
| B | 向某钠盐中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 该钠盐可能为Na2S2O3 |
| C | 将 样品溶于稀硫酸,滴加KSCN溶液 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 |  样品已变质 样品已变质 |
| D | 向盛有过量AgNO3溶液的试管中滴加少量NaCl溶液,再向其中滴加Na2CrO4溶液 | 先观察到白色沉淀,后产生砖红色沉淀 | AgCl沉淀可转化为更难溶的沉淀Ag2CrO4 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-26更新
|
267次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
名校
解题方法
6 . 水溶液中的离子反应与平衡在工农业生产和日常生活中有着广泛的应用,下列说法错误的是
| A.明矾净水的原理与Al3+的水解有关 |
| B.用醋酸浸泡可以除去锅炉水垢中的CaSO4 |
| C.误服BaCl2或BaCO3后可用Na2SO4溶液解毒 |
D.长期使用 化肥的土壤酸性会增强 化肥的土壤酸性会增强 |
您最近一年使用:0次
2022-11-26更新
|
294次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
名校
解题方法
7 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 向溶液X中滴加浓盐酸,将产生气体通入品红溶液,溶液褪色 | 证明溶液X中含有 或 或 |
| B | 室温下,向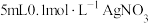 溶液中加入几滴 溶液中加入几滴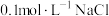 溶液出现白色沉淀,再滴加几滴 溶液出现白色沉淀,再滴加几滴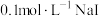 溶液,出现黄色沉淀 溶液,出现黄色沉淀 | 证明相同温度下: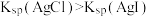 |
| C | 常温下,测得相同浓度溶液的 : : | 证明常温下的水解程度: |
| D | 将 溶液滴入酸性 溶液滴入酸性 溶液中,紫红色褪去 溶液中,紫红色褪去 | 证明 有还原性 有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-02更新
|
1366次组卷
|
4卷引用:江西省新余市2022-2023学年高二上学期期末质量检测化学试题
名校
解题方法
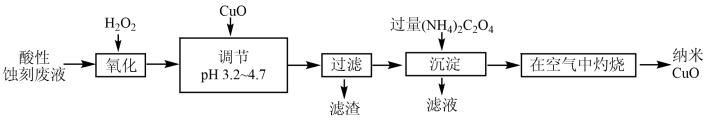
8 . 以印刷线路板酸性蚀刻废液(含有CuCl2、FeCl2、FeCl3)为原料制备纳米CuO的流程如图:
下列说法错误的是

下列说法错误的是
| A.“沉淀”产生的CuC2O4,不洗涤直接灼烧不影响产品质量 |
| B.“在空气中灼烧”时发生了非氧化还原反应 |
| C.调节pH为3.2~4.7的目的是使Fe3+完全沉淀,Cu2+不沉淀 |
| D.“沉淀”过程中用Na2C2O4代替(NH4)2C2O4,得到的CuC2O4中可能混有Cu(OH)2 |
您最近一年使用:0次
2022-06-01更新
|
720次组卷
|
6卷引用:江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题
解题方法
9 . 下列有关实验操作、现象及结论都正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 溶液变蓝色 | Fe3+的氧化性比I2的强 |
| B | 将淀粉和稀硫酸混合加热一段时间后,再加入新制的Cu(OH)2悬浊液,加热 | 产生砖红色沉淀 | 淀粉在稀硫酸、加热条件下水解为葡萄糖 |
| C | 取一支试管装入2 mL2 mol/LNaOH溶液,先滴加1 mL1 mol/LMgCl2溶液,溶液再滴加几滴1mol/LCuCl2 | 先生成白色沉淀,后沉淀变为蓝色 | Ksp[Cu(OH)2<Ksp[Mg(OH)2 |
| D | 两支试管各盛4mL0.1mol/L酸性高锰酸钾溶液,分别加入2mL0.1mol/L的草酸溶液和2mL0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液完全褪色时间更短 | 反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 已知25℃时, 的平衡常数
的平衡常数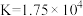 ,
,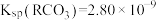 ,下列叙述中正确的是
,下列叙述中正确的是
 的平衡常数
的平衡常数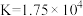 ,
,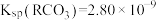 ,下列叙述中正确的是
,下列叙述中正确的是A.25℃时,RSO4的Ksp的为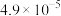 |
B.将浓度均为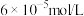 的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀 的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀 |
C.向c( )=c( )=c( )的混合液中滴加RCl2溶液,首先析出RSO4沉淀 )的混合液中滴加RCl2溶液,首先析出RSO4沉淀 |
| D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp |
您最近一年使用:0次
2021-11-16更新
|
1001次组卷
|
16卷引用:江西省新余市第一中学2019-2020学年高二上学期第二次段考试化学试题
江西省新余市第一中学2019-2020学年高二上学期第二次段考试化学试题【全国百强校】湖南省长沙市长郡中学2018届高三高考押题卷(二)理综化学试题(已下线)《考前20天终极攻略》-5月23日 溶液中的离子平衡辽宁省普兰店市第一中学2018-2019学年高二(理)上学期期中考试化学试题(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)3.4 难溶电解质的溶解平衡(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)辽宁省辽东南协作体2021-2022学年高二上学期期中考试化学试题河北省唐山市第一中学2021-2022学年高二上学期12月月考化学试题(已下线)3.4.2 沉淀溶解平衡的应用(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)作业(二十) 沉淀溶解平衡与溶度积湖南省长沙市第一中学2023-2024学年高二下学期入学考试化学试题




