解题方法
1 . 向 溶液中滴加NaCl溶液,发生反应
溶液中滴加NaCl溶液,发生反应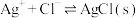 和
和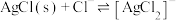 。
。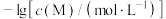 与
与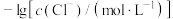 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 或
或 )。下列说法正确的是
)。下列说法正确的是
 溶液中滴加NaCl溶液,发生反应
溶液中滴加NaCl溶液,发生反应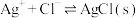 和
和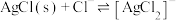 。
。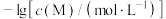 与
与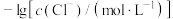 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 或
或 )。下列说法正确的是
)。下列说法正确的是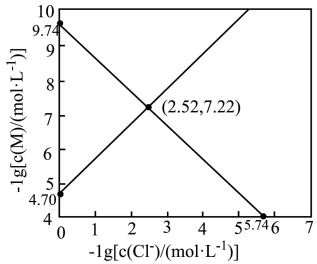
A.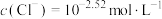 时,溶液中 时,溶液中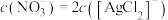 |
B. 时,溶液中 时,溶液中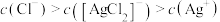 |
C.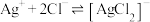 的平衡常数K的值为 的平衡常数K的值为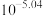 |
D.用 沉淀 沉淀 ,溶液中 ,溶液中 浓度越大,沉淀效果越好 浓度越大,沉淀效果越好 |
您最近一年使用:0次
解题方法
2 . 下列实验操作不能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 提纯 | 将含少量 的 的 固体溶于足量浓氨水中,过滤、洗涤、干燥 固体溶于足量浓氨水中,过滤、洗涤、干燥 |
| B | 向 溶液中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色的变化 溶液中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色的变化 |  的还原性比 的还原性比 的强 的强 |
| C | 室温下,向一定量饱和 溶液中通入足量 溶液中通入足量 气体,观察是否有晶体析出 气体,观察是否有晶体析出 | 室温下固体在水中的溶解性: |
| D | 用pH计测量相同温度、相同浓度NaClO溶液、 溶液的pH,比较pH大小 溶液的pH,比较pH大小 | HClO的酸性比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是___________ (写化学式)。
②等浓度的 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为___________ 。
(2)室温下,用 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。
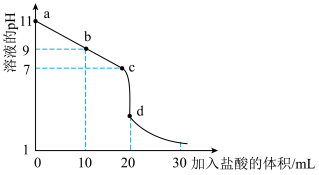
①该中和滴定选用___________ (填“甲基橙”或“酚酞”)作指示剂。
②室温下, 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为___________ 
③b点所示的溶液中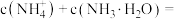
___________ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。当把水垢中 完全转化时,混合溶液中的
完全转化时,混合溶液中的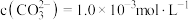 ,则
,则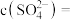
___________  (保留小数点后一位)。
(保留小数点后一位)。
已知: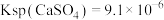 ,
,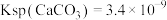
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
| 电离平衡常数 | 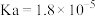 | 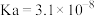 | 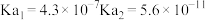 |
 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是②等浓度的
 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为(2)室温下,用
 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。
①该中和滴定选用
②室温下,
 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为
③b点所示的溶液中
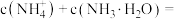
(3)工业上向锅炉里注入所得到的
 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 完全转化时,混合溶液中的
完全转化时,混合溶液中的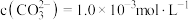 ,则
,则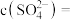
 (保留小数点后一位)。
(保留小数点后一位)。已知:
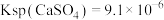 ,
,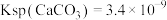
您最近一年使用:0次
名校
解题方法
4 . 高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含金属单质 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
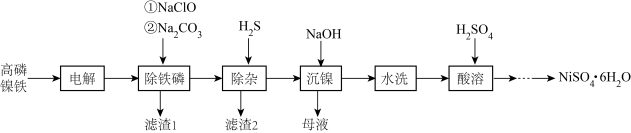
(1)“电解”时,选用 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作___________ (填“阳极”或“阴极”);另一极的主要电极反应为:_____________________ 。此外,溶液中的 有部分在阴极放电。
有部分在阴极放电。
(2)“沉镍”时,离子方程式为___________________________________________ ,为确保镍沉淀完全,理论上应调节溶液
_____________ (已知:在该工业环境下, ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)已知: 时,
时, 、
、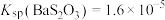 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为________ 。
(4)从 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:___________ 、__________ 、过滤、洗涤、干燥。
 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
(1)“电解”时,选用
 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作 有部分在阴极放电。
有部分在阴极放电。(2)“沉镍”时,离子方程式为

 ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)已知:
 时,
时, 、
、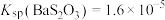 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为(4)从
 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:
您最近一年使用:0次
2024-03-01更新
|
109次组卷
|
2卷引用:江西省上饶市2023-2024学年高二上学期期末教学质量测试化学试卷
名校
解题方法
5 . 室温下,下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将1mL0.1mol/L 溶液滴入5mL 0.1mol/L NaOH溶液有沉淀产生,再滴加0.1mol/L 溶液滴入5mL 0.1mol/L NaOH溶液有沉淀产生,再滴加0.1mol/L 溶液 溶液 | 先有白色沉淀生成,后变为浅蓝色沉淀 | 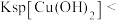 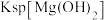 |
| B | 向浓度均为0.1mol/L的 和 和 混合溶液中滴加0.1mol/L 混合溶液中滴加0.1mol/L 溶液 溶液 | 先出现黄色沉淀 |  还原性强于 还原性强于 |
| C | 室温时,在pH试纸上滴2~3滴 溶液 溶液 | 测得, |  溶液中 溶液中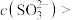  |
| D | 用pH计测量相同浓度NaClO溶液和 溶液的pH值 溶液的pH值 | NaClO溶液的pH值大于 溶液 溶液 |  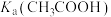 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-29更新
|
416次组卷
|
2卷引用:江西省上饶市第一中学2023-2024学年高二下学期开学考试化学试题
名校
6 . 下列实验操作、现象、解释或结论都正确的是
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 在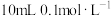 的 的 溶液中依次滴入几滴 溶液中依次滴入几滴 溶液和KI溶液 溶液和KI溶液 | 溶液先产生白色沉淀,后又产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 将 通入 通入 溶液 溶液 | 有白色沉淀生成 | 生成了 沉淀 沉淀 |
| C | 向某钠盐粉末上滴加浓盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为 、 、 或 或 |
| D | 在 溶液中通入 溶液中通入 气体 气体 | 有沉淀生成 | 沉淀为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-16更新
|
359次组卷
|
3卷引用:江西省上饶市清源学校2023-2024学年高二上学期12月考试化学试题
名校
解题方法
7 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
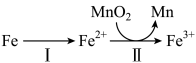
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
175次组卷
|
3卷引用:江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷
8 . 处理废旧电池[主要含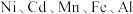 、铼
、铼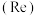 ]的流程如下:
]的流程如下:
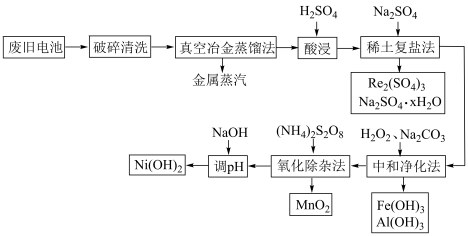
下列说法正确的是
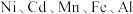 、铼
、铼 ]的流程如下:
]的流程如下:
下列说法正确的是
A.金属 的沸点高于其他金属 的沸点高于其他金属 |
B.生成复盐的离子方程式为 |
C.在实际中和净化过程中,需要的 与 与 的物质的量之比应为 的物质的量之比应为 |
D. 中, 中, 为 为 价,其中含有2个过氧键 价,其中含有2个过氧键 |
您最近一年使用:0次
2023-12-09更新
|
262次组卷
|
2卷引用:江西省上饶市广丰中学2023-2024学年高二上学期12月考试化学试卷
名校
9 . 常温下,用 溶液分别滴定浓度均为0.01 mol⋅L
溶液分别滴定浓度均为0.01 mol⋅L 的KCl、
的KCl、 溶液,所得的沉淀溶解平衡图像如图所示(不考虑
溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。
的水解)。
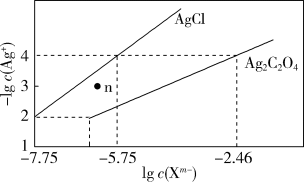
下列叙述正确的是
A. 的数量级等于 的数量级等于 |
| B.n点表示AgCl的饱和溶液 |
C.向浓度相同的KCl、 混合溶液中滴入 混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.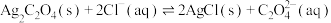 的平衡常数为 的平衡常数为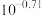 |
您最近一年使用:0次
2023-12-02更新
|
366次组卷
|
2卷引用:江西省上饶市婺源县天佑中学2023-2024学年高二上学期12月考试化学试题
名校
解题方法
10 . 下列实验目的、方案设计和现象、结论都正确的是
| 实验目的 | 方案设计和现象 | 结论 | |
| A | 比较KMnO4、Cl2和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性:KMnO4>Cl2>Fe3+ |
| B | 检验某溶液中是否含有Fe2+ | 取少量待检液于试管中,先滴加KSCN溶液,无明显变化,再滴加新制氯水,变为红色溶液 | 该溶液一定含有Fe2+ |
| C | 比较Ksp(AgCl)、Ksp(AgI)的大小 | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| D | 检验某有机物(如图)中含有醛基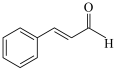 | 取少量待检液于试管中,滴加酸性KMnO4溶液,紫红色褪去 | 该有机物中含有醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-17更新
|
1151次组卷
|
3卷引用:江西省上饶市2024届高三下学期第一次高考模拟考试化学试题
江西省上饶市2024届高三下学期第一次高考模拟考试化学试题广西壮族自治区南宁三中、柳州高中2023-2024学年高三上学期第一次适应性考试化学试题(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)



