名校
1 . 化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关该反应的推理
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确 的是
 CuS(s)+Mn2+(aq)。下列有关该反应的推理
CuS(s)+Mn2+(aq)。下列有关该反应的推理| A.MnS的溶解度比CuS的溶解度大 |
| B.该反应达到平衡时,c(Cu2+)=c(Mn2+) |
| C.向上述平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应平衡常数K=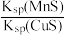 |
您最近一年使用:0次
2020-01-23更新
|
183次组卷
|
9卷引用:江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中联考(自主班)化学试题
江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中联考(自主班)化学试题2015届湖南省岳阳市高三教学质量检测化学试卷高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡河北省唐山一中2017-2018学年高二上学期12月月考化学试题吉林省白城市第一中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】湖北省黄冈市黄冈中学2018-2019高二上学期期中模考化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二下学期开学考试化学试题河北省衡水市深州市中学2020届高三第一次月考化学试题(已下线)第28讲 难溶电解质的溶解平衡 (精练)-2021年高考化学一轮复习讲练测
2 . 某温度时,AgCl(s) Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
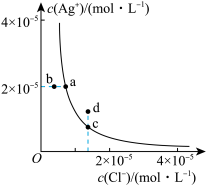
 Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
| A.加入AgNO3可以使溶液由c点变到d点 |
| B.加入NaCl固体则AgCl的溶解度减小,Ksp也减小 |
| C.蒸发溶液可以实现b点到a点的转化 |
| D.图中d点对应的是过饱和溶液 |
您最近一年使用:0次
2020-01-16更新
|
259次组卷
|
4卷引用:江西省余干县新时代学校2020-2021学年高二上学期阶段测试(二)化学试题
名校
3 . 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
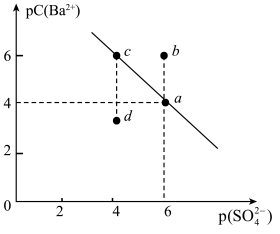

| A.加入BaCl2可以使溶液由c点变到a点 |
| B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4) |
| C.d点表示的是该温度下BaSO4的不饱和溶液 |
| D.该温度下,Ksp(BaSO4)=1.0×10-24 |
您最近一年使用:0次
2020-01-15更新
|
422次组卷
|
14卷引用:江西省横峰中学2017-2018学年高二上学期第三次月考化学试题
江西省横峰中学2017-2018学年高二上学期第三次月考化学试题2014-2015湖北省襄阳市五中高二3月月考化学试卷2015-2016学年河南省南阳一中高二下期末模拟化学试卷河南省驻马店市2016-2017学年高二下学期期末考试化学试题湖北省荆门市2016-2017学年高二下学期期末质量检测化学试题四川省石室中学2017-2018学年高二上学期半期考试化学试题江西省南昌市第二中学2017-2018学年高二上学期第三次月考化学试题【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——沉淀溶解平衡的曲线分析江西省赣县第三中学2020-2021学年高二上学期12月月考化学试题(已下线)题型27 沉淀溶解平衡常数及其应用图象
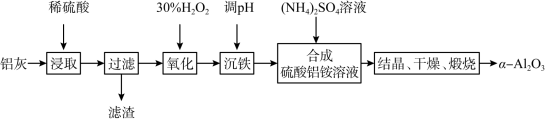
4 . 以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:_____ (填选项编号)。___________________________________ 。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
为保证产品的纯度,可以选用下列物质中的_______ 调节溶液pH(填字母),调节pH的范围为______________ 。
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3____________ (填化学式)。
②装有KMnO4溶液洗气瓶的作用是____________________________ 。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________ 。写出硫酸铝铵加入足量该试剂的离子方程式__________________________________________________ 。
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____________ mol·L-1(填具体数字计算式,不必化简)

(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
| Fe3+ | Fe2+ | Al3+ | |
| 开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
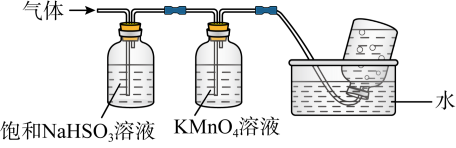
②装有KMnO4溶液洗气瓶的作用是
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=
您最近一年使用:0次
2018-12-17更新
|
288次组卷
|
2卷引用:【校级联考】江西省上饶市弋阳县第一中学等六校2018-2019学年高二(课改班)上学期12月联考化学试题
名校
5 . 化学已渗透到人类生活的各个方面,下列说法正确的是
| A.在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 |
| B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 |
| C.明矾KAl(SO4)2·12H2O溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
| D.处理锅炉内壁的水垢需使用Na2CO3溶液,目的是将Mg(OH)2转化为更难溶的MgCO3 |
您最近一年使用:0次
2018-12-12更新
|
417次组卷
|
3卷引用:江西省上饶市上饶中学2019-2020学年高二上学期第二次月考化学(理科培优班)试题
名校
6 . 下列实验能达到预期目的是
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
| D | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快 | 证明HX酸性比HY强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-11更新
|
633次组卷
|
13卷引用:江西省上饶市2018-2019学年高二下学期期末教学质量测试化学试题
江西省上饶市2018-2019学年高二下学期期末教学质量测试化学试题【全国百强校】重庆市第一中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】甘肃省天水一中2018-2019学年高二上学期期末考试化学试题1【全国百强校】甘肃省天水一中2018-2019学年高二上学期期末考试化学试题2甘肃省兰州市第十中学、民族中学2019-2020学年高二上学期期末考试化学试题四川省遂宁市2019-2020学年高二下学期期末考试化学试题江西省南康中学2020-2021学年高二上学期第四次大考化学试题湖南省邵阳市邵东创新实验学校2020-2021学年高二上学期期末考试化学(选考)试题湖南省常德市芷兰实验中学2020-2021学年高二下学期第一次月考化学试题云南省富宁县一中2020-2021学年高二下学期第一次月考化学试题广西钦州市第一中学2021-2022学年高二下学期期中考试理科综合化学试题山东省临沂市第二中学2021-2022学年高二上学期12月月考化学试题湖南省临湘市第五中学2021-2022学年高二上学期第三次月考化学试题
2018高三上·全国·专题练习
名校
7 . 某温度时,AgCl的溶解平衡曲线如图所示。已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。下列说法错误的是
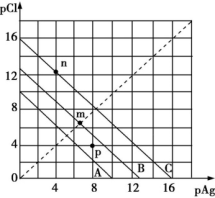

| A.A线、B线、C线对应的温度关系:A>B>C |
| B.A线对应温度下,AgCl的Ksp=1×10-10 |
| C.B线对应温度下,p点形成的溶液是AgCl的不饱和溶液 |
| D.C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀 |
您最近一年使用:0次
2018-10-23更新
|
321次组卷
|
3卷引用:江西省上饶市上饶中学2019-2020学年高二上学期第二次月考化学(理科培优班)试题
江西省上饶市上饶中学2019-2020学年高二上学期第二次月考化学(理科培优班)试题(已下线)2018年10月16日 《每日一题》一轮复习-沉淀溶解平衡2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】
8 . 下列说法正确的是
| A.在一定温度下的饱和AgCl水溶液中,Ag+与Cl-的浓度乘积是一个常数 |
| B.已知AgCl的Ksp=1.8×10-10,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-),且Ag+与Cl-浓度的乘积等于1.8×10-10mol2·L-2 |
| C.Ksp数值越大的难溶电解质在水中的溶解能力越强 |
| D.难溶电解质的溶解度很小,故外界条件改变,对它的溶解度没有影响 |
您最近一年使用:0次
9 . 工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤。请回答以下问题:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
(1)将浓盐酸溶解粗CuO粉末后,溶液中的金属阳离子含有___________ ,第一步除去该溶液中的Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去?_____ ,(填“能” 或“不能”)理由是 _____________________________________________________________
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的pH将Fe3+沉淀除去:你认为用NaClO作氧化剂是否妥当?_____ (填“是” 或“否”),现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________ (有几个选几个,填代号,下同)。
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)①加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的___________ 。
A.CuO B.NH3·H2O C.NaOH D.Cu(OH)2
②加上述物质调节溶液的pH为3.2~4.7,原因是________________________________________________
(4)最后能不能直接将溶液蒸发得到CuCl2·2H2O?______ (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O____________________________________________ (若填“能”,此空不用回答)
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.6 | 6.7 |
(1)将浓盐酸溶解粗CuO粉末后,溶液中的金属阳离子含有
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的pH将Fe3+沉淀除去:你认为用NaClO作氧化剂是否妥当?
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)①加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的
A.CuO B.NH3·H2O C.NaOH D.Cu(OH)2
②加上述物质调节溶液的pH为3.2~4.7,原因是
(4)最后能不能直接将溶液蒸发得到CuCl2·2H2O?
您最近一年使用:0次
10 . 选考[化学与技术]根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
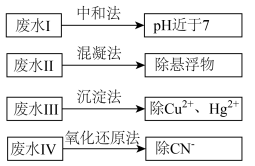
(1)废水I若采用CO2处理,离子方程式是___________ 。
(2)废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO )越大,净水效果越好,这是因为
)越大,净水效果越好,这是因为___________ 。
(3)③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++___________ ═CH3Hg++___________ ;我国规定,Hg2+的排放标准不能超过0.05mg/L。对于含Hg2+的污水,可加入沉淀剂___________ (填写化学式),使Hg2+除去,降低污染。
(4)④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为___________ 。
化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液。
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
(5)I中,量取K2Cr2O7,溶液的仪器是___________ 。
(6)Ⅲ中,发生的反应为:Cr2O +6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=___________ (用含c、V1、V2的表达式表示)。

(1)废水I若采用CO2处理,离子方程式是
(2)废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO
 )越大,净水效果越好,这是因为
)越大,净水效果越好,这是因为(3)③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++
(4)④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为
化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液。
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
(5)I中,量取K2Cr2O7,溶液的仪器是
(6)Ⅲ中,发生的反应为:Cr2O
 +6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
您最近一年使用:0次



