1 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为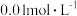 的
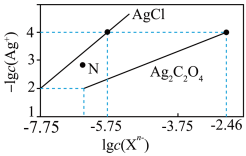
的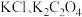 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为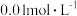 的
的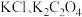 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是 
A.Ksp(Ag2C2O4)的数量级为 |
B. 点表示 点表示 的过饱和溶液 的过饱和溶液 |
C.向c(Cl-)=c(C2O )的混合溶液中滴入 )的混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.常温下,Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+C2O 2AgCl(s)+C2O 的平衡常数为108.04 的平衡常数为108.04 |
您最近一年使用:0次
名校
解题方法
2 . 铋酸钠( )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
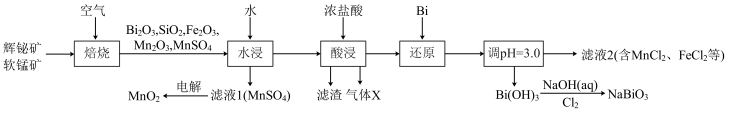
已知:①金属活动性: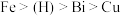 。
。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1) 中Bi的化合价为
中Bi的化合价为___________ 。气体X是___________ (填化学式)。
(2)“焙烧”中 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:___________ 。被还原的元素是___________ (填元素符号)。
(3)“还原”中Bi的作用是___________ 。
(4)检验滤液2中是否有 的试剂是
的试剂是___________ (填化学式)。
(5)已知 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:___________ 。
(6)为探究 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:
___________  (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是___________ 。
 )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性:
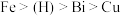 。
。②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.5 | 2.8 |
 | 6.3 | 8.3 |
 | 8.1 | 10.1 |
(1)
 中Bi的化合价为
中Bi的化合价为(2)“焙烧”中
 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:(3)“还原”中Bi的作用是
(4)检验滤液2中是否有
 的试剂是
的试剂是(5)已知
 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:(6)为探究
 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:
实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:

 (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是
您最近一年使用:0次
2023-10-19更新
|
198次组卷
|
2卷引用:江西省抚州市临川区2023-2024学年高三上学期10月月统考化学试题
名校
解题方法
3 . 下列实验操作和实验现象所对应的实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 把分别盛有NaCl溶液和 胶体的两烧杯置于暗处,均用红色激光笔照射烧杯中的液体 胶体的两烧杯置于暗处,均用红色激光笔照射烧杯中的液体 | 观察到 胶体中有一条光亮的通路,NaCl溶液无明显现象 胶体中有一条光亮的通路,NaCl溶液无明显现象 | 丁达尔效应是胶体和溶液的本质区别 |
B | 向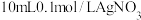 溶液中先滴入5滴0.1mol/LNaCl溶液,再滴入5滴0.1mol/L的KI溶液 溶液中先滴入5滴0.1mol/LNaCl溶液,再滴入5滴0.1mol/L的KI溶液 | 先产生白色沉淀,后产生黄色沉淀 | 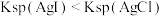 |
C | 向2支试管各加入 的草酸溶液,分别滴加 的草酸溶液,分别滴加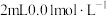 、 、 高锰酸钾溶液 高锰酸钾溶液 | 高锰酸钾溶液褪色并观察褪色时间 | 其他条件不变时,反应物浓度越大,反应速率越快 |
D | 取淀粉溶液于试管中,加入适量稀 后水浴加热5min,冷却后先加足量NaOH溶液,再加入适量新制 后水浴加热5min,冷却后先加足量NaOH溶液,再加入适量新制 悬浊液并加热煮沸 悬浊液并加热煮沸 | 生成砖红色沉淀 | 淀粉已水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-08更新
|
129次组卷
|
2卷引用:江西省乐安县第二中学2023-2024学年高三上学期开学考试化学试题
4 . 化学与生活关系密切,下列说法正确的是
| A.“玉兔二号”月球车使用的太阳能电池板材料是二氧化硅 |
B.水垢中的 ,可先用 ,可先用 溶液处理,而后用酸除去 溶液处理,而后用酸除去 |
| C.为了增强肥效,将草木灰与铵态氮肥混用 |
| D.肼、甲醇等形成燃料电池放出的热量远高于其直接燃烧放出的热量 |
您最近一年使用:0次
5 . 天然水体中的H2CO3与空气中的(CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9,某溶洞水体中lgc(X)(X为H2CO3、 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是

 、
、 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是
A.曲线①代表 |
| B.H2CO3的一级电离常数为10-8.3 |
| C.c(Ca2+)随pH升高而增大 |
| D.pH=10.3时,c(Ca2+)=2.8×10-7.9mol·L-1 |
您最近一年使用:0次
2022-12-04更新
|
1303次组卷
|
22卷引用:江西省抚州市临川第一中学2022届高三下学期4月模拟考试理科综合化学试题
江西省抚州市临川第一中学2022届高三下学期4月模拟考试理科综合化学试题辽宁省2021年普通高中学业水平选择考适应性测试化学试题(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(新高考)四川省射洪市2021届高考考前模拟测试理综化学试题选择性必修1(SJ)专题3专项拓展训练 水溶液中离子平衡图象分析安徽省示范高中培优联盟20212022学年高二上学期冬季联赛化学试题江苏省南京师范大学附属中学2021-2022学年高三下学期开学考试化学试题 湖南省怀化市通道县第一中学2021-2022学年高三下学期4月月考化学试题第三章水溶液中的离子反应与平衡福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第54讲 水溶液中四大平衡常数的综合应用(已下线)易错点3不会利用“特殊点”解电解质溶液图像题(已下线)题型141 Ksp的相关计算(已下线)T15-溶液中的离子平衡(已下线)第5讲 难溶电解质的溶解平衡黑龙江省哈尔滨市第一中学校2022-2023学年高三上学期12月月考化学试题辽宁师范大学附属中学2021-2022学年高三上学期阶段测试化学试题重庆市第一中学校2023-2024学年高二上学期第一次月考化学试题(已下线)选择题11-15湖南省邵阳市邵东市创新高级中学2023-2024学年高二上学期创高杯考试化学试题
名校
解题方法
6 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定中和热 | 将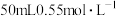 的NaOH溶液一次性迅速倒入盛 的NaOH溶液一次性迅速倒入盛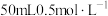 盐酸的烧杯中 盐酸的烧杯中 |
| B | 证明炭可与浓 反应生成 反应生成 | 向浓 中插入红热的炭,产生红棕色气体 中插入红热的炭,产生红棕色气体 |
| C | 证明AgCl的溶解度大于 | 向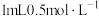 的 的 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液产生黑色沉淀 溶液产生黑色沉淀 |
| D | 制取氨气并干燥 | 加热氯化铵和氢氧化钙的混合物,将产生的气体通过装有无水氯化钙的干燥管 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-30更新
|
268次组卷
|
2卷引用:江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题
7 . 下列实验方案不能达到相应目的的是
| 目的 | A.验证Fe是否被氧化 | B.研究浓度对FeCl3水解平衡的影响 |
| 实验方案 | 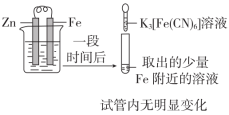 |  |
| 目的 | C.比较CH3COOH和H3BO3(硼酸,一元弱酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
| 实验方案 |  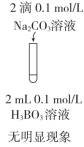 | 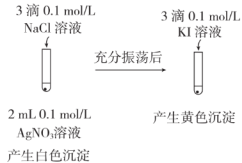 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示 ) ___________ 。
(2)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据( )
)
①25℃时,等物质的量浓度的3种溶液:a.NaCN溶液b.Na2CO3溶液c.CH3COONa溶液,其pH由大到小的顺序为___________ (填序号 ) 。
②25℃时,向 溶液中通入少量的
溶液中通入少量的 ,发生反应的
,发生反应的离子方程式为 ___________ 。
(3)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
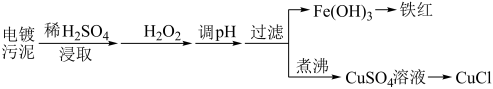
①酸浸后加入 的目的是
的目的是___________ ,调 的最适宜范围为
的最适宜范围为___________ 。
②调pH过程中加入的试剂最好是___________ 。
A.NaOH B.CuO C.NH3⋅H2O D.Cu2(OH)2CO3
③向 溶液中加入一定量的
溶液中加入一定量的 、
、 ,可以生成白色的
,可以生成白色的 沉淀,反应的化学方程式
沉淀,反应的化学方程式___ 。
(1)氯化铁水溶液呈酸性,原因是(
(2)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(
 )
)| 化学式 |  |  |  |
| 电离平衡常数 | 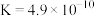 |  | 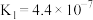  |
②25℃时,向
 溶液中通入少量的
溶液中通入少量的 ,发生反应的
,发生反应的(3)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
 的目的是
的目的是 的最适宜范围为
的最适宜范围为②调pH过程中加入的试剂最好是
A.NaOH B.CuO C.NH3⋅H2O D.Cu2(OH)2CO3
③向
 溶液中加入一定量的
溶液中加入一定量的 、
、 ,可以生成白色的
,可以生成白色的 沉淀,反应的化学方程式
沉淀,反应的化学方程式
您最近一年使用:0次
名校
解题方法
9 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度小于水解程度 在水中的电离程度小于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 向浓度均为0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 | 产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-16更新
|
676次组卷
|
8卷引用:江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题
江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题广东省梅州市兴宁市沐彬中学2021-2022学年高二下学期期中考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题
10 . 关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| B.已知25℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=4.0×104 |
| C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]>Ksp(CaSO4) |
| D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1 |
您最近一年使用:0次
2022-03-10更新
|
487次组卷
|
3卷引用:江西省抚州市南城县第二中学2021-2022年高二上学期第二次月考化学试题



