名校
解题方法
1 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度小于水解程度 在水中的电离程度小于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 向浓度均为0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 | 产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-16更新
|
683次组卷
|
8卷引用:江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题
江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题广东省梅州市兴宁市沐彬中学2021-2022学年高二下学期期中考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题
2 . 关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| B.已知25℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=4.0×104 |
| C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]>Ksp(CaSO4) |
| D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1 |
您最近一年使用:0次
2022-03-10更新
|
491次组卷
|
3卷引用:江西省抚州市南城县第二中学2021-2022年高二上学期第二次月考化学试题
名校
解题方法
3 . 下列方程式书写正确的是
A. 的水解方程式: 的水解方程式: +2H2O⇌H2CO3+2OH- +2H2O⇌H2CO3+2OH- |
B.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+ (aq) (aq) |
C.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++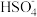 |
D.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为 已知H2SO4溶液与NaOH溶液发生反应的中和热为57.3kJ/mol:H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol 已知H2SO4溶液与NaOH溶液发生反应的中和热为57.3kJ/mol:H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol |
您最近一年使用:0次
名校
解题方法
4 . 对电镀污泥(含Cu,Ca,Ni,Fe的氢氧化物)进行无害化和资源化处理,从其中回收金属、并制备硫酸镍的工艺流程如下图所示:
已知:氯酸不稳定,易发生歧化反应,可生成 气体。
气体。
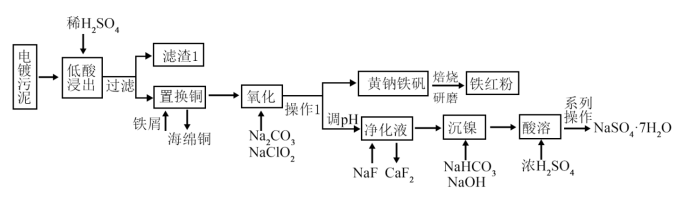
(1)“低酸浸出”工序提高浸出率的措施为___________ (只写一条即可),实验室配制500mL 1.84mol/L该低酸溶液应量取质量分数为98%,密度为 的浓硫酸
的浓硫酸___________ mL。
(2)“氧化”工序中被氧化的元素为___________ (填元素符号),“氧化”工序中加入试剂 调pH的原因为
调pH的原因为___________ (结合离子方程式解释原因),写出氧化工序生成黄钠铁矾 的离子方程式
的离子方程式___________ 。
(3)控制净化液的pH不能过低,否则会导致 沉淀不完全,原因为
沉淀不完全,原因为___________ [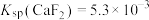 ,
,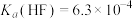 ]。
]。
(4)酸溶后的“系列操作”为___________ ,过滤、洗涤、干燥,该结晶工序得到的废液可以返回___________ 工序循环利用。
已知:氯酸不稳定,易发生歧化反应,可生成
 气体。
气体。
(1)“低酸浸出”工序提高浸出率的措施为
 的浓硫酸
的浓硫酸(2)“氧化”工序中被氧化的元素为
 调pH的原因为
调pH的原因为 的离子方程式
的离子方程式(3)控制净化液的pH不能过低,否则会导致
 沉淀不完全,原因为
沉淀不完全,原因为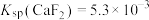 ,
,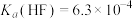 ]。
]。(4)酸溶后的“系列操作”为
您最近一年使用:0次
2021-10-17更新
|
41次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷
名校
5 . 室温下,通过下列实验探究NH4HCO3溶液的性质。
下列有关说法正确的是
| 实验 | 实验操作 |
| 1 | 用pH试纸测定0.1mol/LNH4HCO3溶液的pH,测得pH约为8 |
| 2 | 将浓度均为0.1mol/LNH4HCO3溶液和Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体 |
| 3 | 将等体积1mol/LNH4HCO3与NaCl溶液混合,析出晶体 |
| 4 | 向1mol/LNH4HCO3溶液中滴加0.1mol/LAlCl3溶液,产生白色沉淀,逸出无色气体 |
A.1mol/LNH4HCO3溶液中存在 |
B.根据实验2的现象可以得出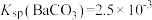 |
C.实验3静置后的上层清液中有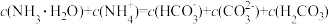 |
D.实验4中产生的气体是 和 和 混合气体 混合气体 |
您最近一年使用:0次
2021-10-12更新
|
1094次组卷
|
9卷引用:江西省金溪县第一中学2023届高三上学期第一次月考化学试题
江西省金溪县第一中学2023届高三上学期第一次月考化学试题江苏省(盐城中学、南通中学)2021-2022学年高三上学期第一次大联考化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期期中考试化学试题2021年北京高考化学试题变式题11-19江苏省扬州中学2021-2022学年高三下学期3月月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)押江苏卷第11题 化学实验综合选择题 -备战2022年高考化学临考题号押题(江苏卷)河北省衡水中学2022届高三第一次模拟考试化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
6 . 近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1.3×10-33,P204[二(2-乙基己基)磷酸酯]常用于萃取锰,P507(2-乙基己基磷酸-2-乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴和镍。

回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式:___________ ,将浸出液pH调至4的目的是___________ 。
(2)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)⇌MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)⇌MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为___________ 。
(3)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
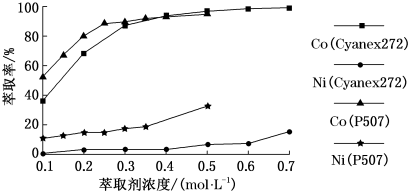
由图可知,钴、镍的萃取率随萃取剂浓度增大而___________ (填“增大”或“减小”);两种萃取剂中___________ (填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为___________ mol·L-1。
(4)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10-16,则沉镍母液中Ni2+的浓度为2.1×10-11 mol·L-1时,pH=___________ (lg5=0.7)。
已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1.3×10-33,P204[二(2-乙基己基)磷酸酯]常用于萃取锰,P507(2-乙基己基磷酸-2-乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴和镍。

回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式:
(2)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)⇌MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)⇌MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
(3)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

由图可知,钴、镍的萃取率随萃取剂浓度增大而
(4)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10-16,则沉镍母液中Ni2+的浓度为2.1×10-11 mol·L-1时,pH=
您最近一年使用:0次
名校
解题方法
7 . 下述实验操作不能达到实验目的的是
| 编号 | 实验目的 | 实验操作及现象 |
| A | 检验溶液中是否存在 | 向待测液中先加稀盐酸酸化,再加氯化钡,产生白色沉淀 |
| B | 验证 的还原性 的还原性 |  溶液中加入酸性 溶液中加入酸性 溶液, 溶液, 溶液褪色 溶液褪色 |
| C | 比较碳酸和硅酸的酸性强弱 | 在 中加浓盐酸并将反应后所得气体直接通入 中加浓盐酸并将反应后所得气体直接通入 溶液中,溶液变浑浊 溶液中,溶液变浑浊 |
| D | 比较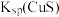 与 与 的大小 的大小 | 将 气体通入浓度均为 气体通入浓度均为 的 的 和 和 混合溶液中,先出现CuS黑色沉淀 混合溶液中,先出现CuS黑色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-09-06更新
|
637次组卷
|
3卷引用:江西省抚州市黎川县第一中学2021-2022学年上学期高三第三次同步考试化学试题
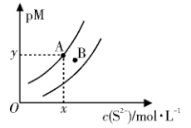
8 . 常温下, 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示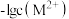 。下列说法正确的是
。下列说法正确的是
 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示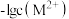 。下列说法正确的是
。下列说法正确的是
A.常温下,B点为 的不饱和溶液 的不饱和溶液 |
B.若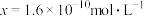 ,则 ,则 |
| C.若对A点浊液加热,A点沿曲线向上移动 |
D.在 和 和 同时沉淀的浊液中, 同时沉淀的浊液中, |
您最近一年使用:0次
2021-07-06更新
|
762次组卷
|
10卷引用:江西省抚州市2021-2022学年高二上学期期末学生学业质量监测化学试题
江西省抚州市2021-2022学年高二上学期期末学生学业质量监测化学试题四川省乐山市2020-2021学年高二下学期期末考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)四川省成都外国语学校2021-2022学年高二下学期入学考试化学试题四川省遂宁中学校2021-2022学年高二下学期期中考试化学试题四川省南充市南部县第二中学2021-2022学年高二下学期5月月考化学试题山东师范大学附属中学2022-2023学年高二上学期期中水平测试化学试题广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题广东省东莞市东莞中学松山湖学校2023-2024学年高二上学期期中考试化学试题 江西省南昌市第十中学2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
9 . 证据推理是学习化学的重要方法,下列证据与推理的关系正确的是
| 选项 | 证据 | 推理 |
| A | 用pH试纸测得0.1mol·L-1Na2CO3溶液的pH等于10,测得0.1mol·L-1醋酸钠溶液的pH等于9 | 酸性:醋酸强于碳酸 |
| B | 向淀粉KI稀溶液中滴加过量新制氯水,溶液最终未呈蓝色 | 氯气和碘离子未发生反应 |
| C | 向1mL0.2mol·L-1AgNO3溶液中依次加入1mL浓度均2mol·L-1的NaCl溶液和KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 向淀粉溶液中加入稀硫酸,水浴加热后,再加入银氨溶液水浴加热,未出现银镜 | 淀粉未发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . (1)醋酸钠水溶液pH>7,原因是(用离子方程式表示):_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的_______ 。
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于_______
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为_______ mol·L-1,pH为_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为
您最近一年使用:0次
2021-03-02更新
|
213次组卷
|
3卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题



