解题方法
1 . 回答下列问题:
(1)对同一个反应,化学平衡常数K的大小能说明_______ ,K越大,_______ 越大;弱酸、弱碱的电离平衡常数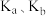 能够反映
能够反映_______ ;难溶电解质的溶度积常数 的大小反映了
的大小反映了_______ ,升高温度时,
_______ (填“增大”、“减小”或“无法判断”)。
(2)向 溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:
溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:_______ 。
(3)常温时,向浓度均为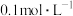 的
的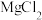 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,先生成的沉淀的颜色为
溶液,先生成的沉淀的颜色为_______ ,生成该沉淀的离子方程式为_______ 。{已知常温时,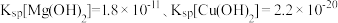 ﹜
﹜
(4)常温时,向浓度为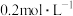 的
的 溶液中滴加同浓度的
溶液中滴加同浓度的 溶液,当恰好沉淀完全时,溶液的
溶液,当恰好沉淀完全时,溶液的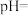
_______ 。(忽略溶液混合引起的体积变化)
(1)对同一个反应,化学平衡常数K的大小能说明
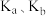 能够反映
能够反映 的大小反映了
的大小反映了
(2)向
 溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:
溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:(3)常温时,向浓度均为
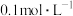 的
的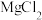 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,先生成的沉淀的颜色为
溶液,先生成的沉淀的颜色为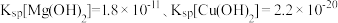 ﹜
﹜(4)常温时,向浓度为
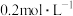 的
的 溶液中滴加同浓度的
溶液中滴加同浓度的 溶液,当恰好沉淀完全时,溶液的
溶液,当恰好沉淀完全时,溶液的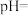
您最近一年使用:0次
2021-01-27更新
|
49次组卷
|
2卷引用:江西省抚州市2020-2021学年高二上学期学生学业水平测试化学试题
2 . 软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如下:

已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为___________ ;
(2)第1步除杂中加入H2O2的目的是___________ 。
(3)第1步除杂中形成滤渣l的主要成分为___________ (填化学式),调pH至5-6所加的试剂,可选择___________ (填以下试剂的序号字母)
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式___________ ,该反应的平衡常数数值为___________ 。(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11):
(5)采用“趁热过滤”操作的原因是___________ 。

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(2)第1步除杂中加入H2O2的目的是
(3)第1步除杂中形成滤渣l的主要成分为
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式
(5)采用“趁热过滤”操作的原因是
您最近一年使用:0次
2021-01-04更新
|
113次组卷
|
2卷引用:江西省抚州市临川第一中学2023-2024学年高二上学期期中考试 化学试卷
名校
解题方法
3 . 下列实验操作能达到实验目的的是
| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-24更新
|
624次组卷
|
8卷引用:江西省抚州市黎川县第一中学2020-2021学年高二上学期第三次月考化学试题
4 . 室温下,向20mL含有0.10mol/LCr2+和0.10mol/LFe2+的混合溶液中滴加0.10mol/LNaOH溶液,金属阳离子的浓度与滴入NaOH溶液体积的关系如图所示。若溶液中金属阳离子浓度小于10-5mol/L可视为完全沉淀,则下列说法错误的是( )

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3
| A.曲线A表示c(Fe2+)与NaOH溶液体积的关系 |
| B.当V(NaOH溶液)=30mL时,Cr2+开始沉淀 |
| C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀 |
| D.当V(NaOH溶液)>30mL时,溶液中c(Fe2+):c(Cr2+)=4 |
您最近一年使用:0次
2020-11-21更新
|
330次组卷
|
3卷引用:江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题
名校
解题方法
5 . 将 的饱和石灰水冷却至
的饱和石灰水冷却至 ;或加入少量
;或加入少量 但温度仍保持
但温度仍保持 ,在这两种情况下均未改变的是
,在这两种情况下均未改变的是
 的饱和石灰水冷却至
的饱和石灰水冷却至 ;或加入少量
;或加入少量 但温度仍保持
但温度仍保持 ,在这两种情况下均未改变的是
,在这两种情况下均未改变的是A. 的溶解度、溶剂的质量 的溶解度、溶剂的质量 | B.溶液中溶质的质量分数 |
| C.溶液的质量、水的电离平衡 | D.溶液中 的数目、 的数目、 的溶解平衡 的溶解平衡 |
您最近一年使用:0次
2020-09-07更新
|
82次组卷
|
2卷引用:江西省抚州市南城县第二中学2021-2022年高二上学期第二次月考化学试题
6 . 常温下,下列有关电解质溶液的说法错误的是
A.相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则  |
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中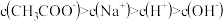 |
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则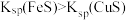 |
D.在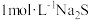 溶液中, 溶液中, |
您最近一年使用:0次
2020-07-11更新
|
7102次组卷
|
41卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题
江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题2020年天津卷化学高考试题(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编陕西省黄陵县中学2020-2021学年高二上学期期中考试化学试题(高新部)(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题(已下线)第27讲 盐类水解(精讲)——2021年高考化学一轮复习讲练测山东省济南市山东省实验中学西校2021届高三上学期10月份月考化学试题(已下线)小题必刷33 粒子浓度大小比较——2021年高考化学一轮复习小题必刷(通用版本)(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题辽宁省大连市普兰店区第二中学2020-2021学年高二4月阶段性测试化学试题山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)02(含考试版、答题卡、参考答案、全解全析)(已下线)难点6 水溶液中的四大平衡常数-2021年高考化学专练【热点·重点·难点】选择性必修1 专题3素养检测(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)河北省张家口市第一中学2020-2021学年高二上学期10月月考(衔接班)化学 试题(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题河南省濮阳市第一高级中学2021-2022学年高二上学期期中质量检测化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习吉林省长春外国语学校2021-2022学年高二下学期期初考试化学试题湖南省长沙市南雅中学2021-2022学年高二下学期期中考试化学试题(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)吉林省乾安县第七中学2021-2022学年高二上学期第三次质量检测化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)【2022】【高二上】【期中考】【高中化学】59北京市 首都师范大学附属中学2021-2022学年高二上学期期末考试化学试卷天津市第九十五中学益中学校2023-2024学年高二上学期12月月考化学试题天津市九十六中学2023-2024学年高三上学期12月月考化学试题安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
7 . 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中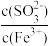 变化的曲线如图所示。
变化的曲线如图所示。

实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
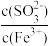 变化的曲线如图所示。
变化的曲线如图所示。
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
| A.检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液 |
B.c点和d点出现上述现象的主要原因是Fe3+和 发生双水解反应 发生双水解反应 |
C.b点较a点溶液pH升高的主要原因:2Fe3++ +H2O = 2Fe2++ +H2O = 2Fe2++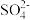 +2H+ +2H+ |
| D.向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+ |
您最近一年使用:0次
真题
名校
8 . 下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 减小 减小 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大 增大 |
C.向盐酸中加入氨水至中性,溶液中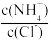 >1 >1 |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 不变 不变 |
您最近一年使用:0次
2020-04-02更新
|
5596次组卷
|
44卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题
江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届四川省成都七中高三上学期10月阶段测化学卷2017届湖北省荆州中学高三上第四次质检化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题湖北省荆州中学2018届高三第二次月考化学试题福建省福州市2016-2017学年高二上学期期中考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第四次月考(12月)化学试题河南省中原名校(即豫南九校)2017-2018学年高二上学期第二次联考化学试题天津市和平区2017-2018学年高二上学期期末考试化学试题天津市静海县第一中学2017-2018学年高二上学期期末终结性检测化学试题江西省南昌市第二中学2017-2018学年高二上学期期末考试化学试题(已下线)《考前20天终极攻略》6月1日 专项一 四大平衡常数及其应用内蒙古北京八中乌兰察布分校2017-2018学年高二下学期第二次调研考试化学试题【全国校级联考】内蒙古赤峰市重点高中(赤峰二中,平煤高级中学等)2017-2018学年高二下学期期末联考(A)化学试题(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密广东省蓝精灵中学2018-2019学年高二上学期联考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)上学期期中考试化学试题吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高二下学期开学考试化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)云南省马关县二中2020届高三上学期开学考试化学试题河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题陕西省榆林市第二中学2019-2020学年高二上学期期中考试化学试题(已下线)专题8.3 盐类水解(练)-《2020年高考一轮复习讲练测》北京市2019—2020学年高二上学期期末考试模拟试题(选修4人教版 )2019—2020学年高二上学期化学期末复习—选择题专题训练一西藏自治区日喀则市南木林高级中学2020届高三上学期第四次月考理综化学试题重庆市云阳江口中学校2019-2020学年高二上学期第二次月考化学试题江西省南昌市八一中学、洪都中学等六校2019-2020学年高二上学期期末联考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 水解平衡常数的应用(强化练习)重庆市江北中学2019-2020学年高二上学期期末模拟考试化学试题河南省南阳市2019-2020学年高二上学期期终质量评估化学试题安徽省黄山市2019-2020学年高二上学期期末质量检测 化学(理)试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江西省吉安市省重点中学2020-2021学年高二上学期期中联合考试化学试题河北省安平中学2019-2020学年高二上学期第四次月考化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)
12-13高二下·江西抚州·期末
名校
9 . 如表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入NaZ,沉淀又转化为AgZ。则表中a、b、c的大小关系为
| 相关化合物 | AgX | AgY | AgZ |
| pKsp | a | b | c |
| A.a>b>c | B.a<b<c | C.c<a<b | D.a+b=c |
您最近一年使用:0次
2020-01-16更新
|
486次组卷
|
7卷引用:2012-2013学年江西省抚州市高二下学期期末考试化学试卷
(已下线)2012-2013学年江西省抚州市高二下学期期末考试化学试卷广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下学期期末考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二上学期期末考试化学试题(已下线)第5讲 难溶电解质的溶解平衡
13-14高三上·湖北黄冈·阶段练习
名校
10 . 为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 重结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
| A.①③ | B.①④ | C.② | D.③④ |
您最近一年使用:0次
2019-09-07更新
|
567次组卷
|
12卷引用:2016届江西省临川区第一中学高三上学期第一次月考化学试卷
2016届江西省临川区第一中学高三上学期第一次月考化学试卷(已下线)2014届湖北省黄冈中学、黄石二中、鄂州高中高三11月联考化学试卷(已下线)2014届黑龙江省大庆一中高三下学期第二阶段考试化学试卷黑龙江省哈尔滨师范大学附属中学2020届高三9月月考化学试题湖南岳阳七中2020届高三9月化学考试题(已下线)第17单元 有机化学基础(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷江西省分宜中学2020-2021学年高二下学期第一次段考化学试题甘肃省兰州市教育局第四片区2021-2022学年高二下学期期中考试化学(理)试题湖南省益阳市第一中学2021-2022学年高二下学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三9月月考化学试题辽宁省锦州市锦州中学2023届高三上学期9月月考化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期第二次月考化学试题



