名校
1 . 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知常温下Ksp(CaSO4)=9×10-6.下列说法正确的是

| A.升高温度曲线会往左下方移动 |
| B.b点加水可以变到b',且此时的Ksp(CaSO4)=9×10-6 |
| C.d点表示CaSO4的过饱和溶液 |
| D.加入Na2SO4(s),可以使溶液由c点变到a点 |
您最近一年使用:0次
名校
2 . 废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量BaSO4、Fe2O3、Al2O3等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。
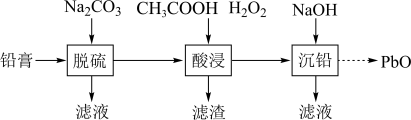
已知:i.一些难溶电解质的溶度积常数如表:
ii.浓度为0.1mol•L-1的一些金属离子生成氢氧化物沉淀时的pH如表:
回答下列问题:
(1)在“脱硫”中,PbSO4发生转化反应的离子方程式为______ 。
(2)在“酸浸”中,除加入CH3COOH,还要加入H2O2。
①H2O2除了能将Fe(II)转化为Fe(III),还能促进金属Pb在醋酸中转化为(CH3COO)2Pb溶液。H2O2在反应中表现_____ 性。
②H2O2也能使PbO2化为(CH3COO)2Pb溶液,反应中生成的氧化产物是_____ 。(填化学式)
③“酸浸”时,为了加快反应速率,可适当加热。但温度不宜过高,原因可能是______ (写出1条)。
(3)“酸浸”后调节溶液的pH约为4.9,则滤渣的主要成分是______ 。
(4)“沉铅”时,0.1mol/LPb2+在pH=9.1完全沉淀时的浓度是1×10-5mol/L,则Pb(OH)2的Ksp=_____ mol3/L3。

已知:i.一些难溶电解质的溶度积常数如表:
| 难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
| Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Pb(OH)2 |
| 开始沉淀的pH | 1.5 | 6.3 | 3.3 | 7.1 |
| 完全沉淀的pH | 2.8 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中,PbSO4发生转化反应的离子方程式为
(2)在“酸浸”中,除加入CH3COOH,还要加入H2O2。
①H2O2除了能将Fe(II)转化为Fe(III),还能促进金属Pb在醋酸中转化为(CH3COO)2Pb溶液。H2O2在反应中表现
②H2O2也能使PbO2化为(CH3COO)2Pb溶液,反应中生成的氧化产物是
③“酸浸”时,为了加快反应速率,可适当加热。但温度不宜过高,原因可能是
(3)“酸浸”后调节溶液的pH约为4.9,则滤渣的主要成分是
(4)“沉铅”时,0.1mol/LPb2+在pH=9.1完全沉淀时的浓度是1×10-5mol/L,则Pb(OH)2的Ksp=
您最近一年使用:0次
2023-01-13更新
|
226次组卷
|
2卷引用:江西省吉水中学2023届高三下学期一模考试化学试题
3 . 常温下, 的
的 值分别为
值分别为 ,下列说法正确的是
,下列说法正确的是
 的
的 值分别为
值分别为 ,下列说法正确的是
,下列说法正确的是A.反应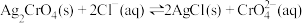 的平衡常数 的平衡常数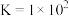 |
B.在食盐水中, 的溶解度及 的溶解度及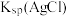 均比在蒸馏水中小 均比在蒸馏水中小 |
C.常温下, 饱和溶液中 饱和溶液中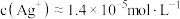 |
D.向饱和 中加入 中加入 溶液有沉淀生成, 溶液有沉淀生成, 减小 减小 |
您最近一年使用:0次
名校
解题方法
4 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向某溶液中滴加 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 溶液中一定含 |
| B | 向 溶液中滴加稀硫酸酸化,再滴加 溶液中滴加稀硫酸酸化,再滴加 溶液,溶液变成血红色 溶液,溶液变成血红色 |  溶液已变质 溶液已变质 |
| C | 向 溶液中逐滴加入少量稀盐酸,无现象 溶液中逐滴加入少量稀盐酸,无现象 | 酸性: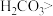 盐酸 盐酸 |
| D | 在足量 溶液中滴入几滴 溶液中滴入几滴 溶液有白色沉淀生成,再滴入 溶液有白色沉淀生成,再滴入 溶液,沉淀变为黑色 溶液,沉淀变为黑色 | 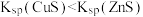 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-22更新
|
315次组卷
|
6卷引用:江西省吉安市第一中学2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
5 . 下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[ 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒
③石灰岩(喀斯特地貌)溶洞的形成
④ 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以
⑤泡沫灭火器灭火原理
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[
 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒 ③石灰岩(喀斯特地貌)溶洞的形成
④
 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以 ⑤泡沫灭火器灭火原理
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
您最近一年使用:0次
2022-04-06更新
|
1220次组卷
|
55卷引用:江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题
江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷河北省衡水中学2016-2017学年高一下学期三调考试化学试题吉林省延边第二中学2017-2018学年高二上学期第二次月考化学试题2017-2018学年四川省乐山四校高二第二学期半期联考化学试题【全国百强校】河北省辛集中学2018-2019学年高二上学期期中考试化学试题(已下线)2019年1月7日 《每日一题》人教选修4-沉淀的生成与溶解【全国百强校】河北省冀州市中学2018-2019学年高二上学期第五次月考化学试题2019年10月20日《每日一题》2020年高考化学一轮复习—— 每周一测黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题北京市2019—2020学年高二上学期期中考试化学试题(选修4人教版)苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡湖南省常德市淮阳中学2019-2020学年高二下学期期中考试化学试题(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡原理的应用(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖北省武汉市钢城四中2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测选择性必修1(SJ)专题3第四单元 沉淀溶解平衡课时1 沉淀溶解平衡及其应用(已下线)专题3.4.2 沉淀溶解平衡的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)北京市首都师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省哈尔滨市第一六二中学2021-2022学年高二上学期期末考试化学试题(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题江苏省天一中学2021-2022学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第26讲 难溶电解质的溶解平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省黄陵中学2021-2022学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山西省太原师范学院附属中学2022-2023学年高二上学期12月月考化学试题山东省淄博市桓台第二中学2021-2022学年高一9月月考化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第52练 难溶电解质的溶解平衡3.4.1沉淀溶解平衡原理 课后(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)作业(二十一) 沉淀溶解平衡的应用
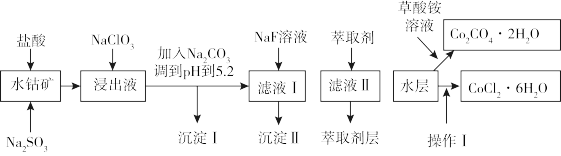
6 . 利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“浸出”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2) 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为_______ 。
(3)加入 调pH至5.2,目的是
调pH至5.2,目的是_______ ;加萃取剂的目的是除去锰元素,则沉淀Ⅱ的主要成分为_______ (填化学式)。
(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,_______ 、_______ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体( )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为_______ 。(已知: 的摩尔质量为
的摩尔质量为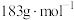 )
)
 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀pH | 3.7 | 9. 6 | 9.2 | 5.2 | 9.8 |
(1)“浸出”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(2)
 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为(3)加入
 调pH至5.2,目的是
调pH至5.2,目的是(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,
(5)将5.49g草酸钴晶体(
 )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。| 温度范围/℃ | 固体质量/g |
| 150〜210 | 4.41 |
| 290〜320 | 2.41 |
 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为 的摩尔质量为
的摩尔质量为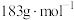 )
)
您最近一年使用:0次
7 . 测定水样中 浓度的实验步骤如下:
浓度的实验步骤如下:
①向锥形瓶中加入25.00mL处理后的水样,加入几滴 溶液;
溶液;
②加入 溶液(过量),充分摇匀;
溶液(过量),充分摇匀;
③用 标准溶液进行滴定,至终点时消耗标准溶液
标准溶液进行滴定,至终点时消耗标准溶液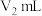 。
。
已知: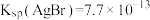 ;
; (白色),
(白色),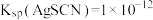 。下列说法错误的是
。下列说法错误的是
 浓度的实验步骤如下:
浓度的实验步骤如下:①向锥形瓶中加入25.00mL处理后的水样,加入几滴
 溶液;
溶液;②加入
 溶液(过量),充分摇匀;
溶液(过量),充分摇匀;③用
 标准溶液进行滴定,至终点时消耗标准溶液
标准溶液进行滴定,至终点时消耗标准溶液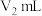 。
。已知:
 ;
; (白色),
(白色),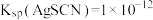 。下列说法错误的是
。下列说法错误的是| A.到达滴定终点时,溶液变为红色 |
| B.该滴定法需在酸性条件下进行 |
C.根据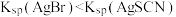 可知,反应 可知,反应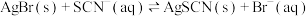 不能发生 不能发生 |
D.该水样中 的浓度 的浓度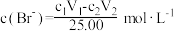 |
您最近一年使用:0次
解题方法
8 . 下列指定反应的离子方程式正确的是
A.向 溶液中通入过量 溶液中通入过量 : :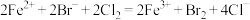 |
B.酸化 和 和 的混合溶液: 的混合溶液: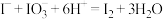 |
C.氧化亚铁溶于稀硝酸: |
D.氢氧化镁溶于氯化铵溶液: |
您最近一年使用:0次
名校
解题方法
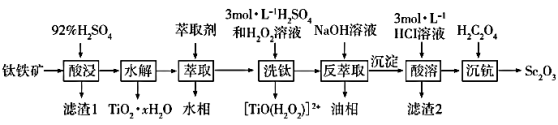
9 . 氧化钪(Sc2O3)是一种稀土氧化物,广泛地应用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为TiO2、FeO、Fe2O3,还含有Mg、Si、Sc等元素,从钛铁矿中提取Sc2O3的流程如图:
已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是___________ 。
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
___________ 。
(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为___________ ,H2O2还起到的作用是___________ 。
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是___________ 。
(5)加草酸“沉钪”的离子方程式为___________ ,获得Sc2O3的实验操作方法是___________ 。

已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是

(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是
(5)加草酸“沉钪”的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 回收利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。从废旧铅蓄电池的铅膏中回收铅的生产流程如下图(部分产物已略去)。
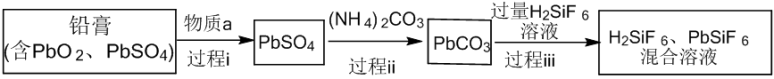
已知: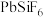 和
和 均为能溶于水的强电解质。下列说法正确的是
均为能溶于水的强电解质。下列说法正确的是

已知:
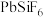 和
和 均为能溶于水的强电解质。下列说法正确的是
均为能溶于水的强电解质。下列说法正确的是| A.物质a表现氧化性 |
B. 易溶于水 易溶于水 |
C.过程iii发生反应的离子方程式为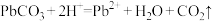 |
| D.过程i、过程ii、过程iii中均有气体生成 |
您最近一年使用:0次
2021-10-11更新
|
309次组卷
|
6卷引用:江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题



