1 . 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:______________ 。
②c点溶液中个离子溶度由大到小的顺序_______________________________
③b点时溶液中c(H2N2O2)_____ c(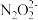 )(填“>”、“<”或 “=”,下同)。
)(填“>”、“<”或 “=”,下同)。
④a点时溶液中c(Na+)____ c(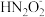 )+c(
)+c(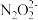 )。
)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中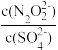 =
=__________ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②c点溶液中个离子溶度由大到小的顺序
③b点时溶液中c(H2N2O2)
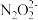 )(填“>”、“<”或 “=”,下同)。
)(填“>”、“<”或 “=”,下同)。④a点时溶液中c(Na+)
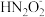 )+c(
)+c(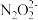 )。
)。(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
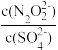 =
=
您最近一年使用:0次
10-11高三下·湖南长沙·阶段练习
名校
2 . 将SO2和X气体分别通入BaCl2未见沉淀产生,若将两者同时通入则产生沉淀,那么X不可能 是( )
| A.Cl2 | B.NH3 | C.H2S | D.CO2 |
您最近一年使用:0次
2018-04-16更新
|
253次组卷
|
14卷引用:2015届江西省遂川中高三上学期第一次月考化学试卷
(已下线)2015届江西省遂川中高三上学期第一次月考化学试卷2016届江西省吉安市安福二中高三上学期第一次月考化学试卷(已下线)2011届湖南省长沙长望浏宁四县市高三3月调研考试理综化学部分(已下线)2010—2011学年浙江省杭州二中高一下学期期中考试化学试卷(已下线)2010—2011学年安徽省师大附中高一下学期期中考查化学试卷(已下线)2013届山西省山大附中高三1月月考化学试卷2016-2017学年安徽省合肥一中高一上开学测化学试卷2015-2016学年河北省石家庄一中高二下期末化学试卷2016-2017学年安徽省淮北市第一中学高一下学期第一次月考化学试卷2016-2017学年广东省佛山市第一中学高一下学期第一次段考化学试卷四川省雅安中学2017-2018学年高一下学期第一次月考化学试题专题4 第一单元 第1课时二氧化硫的性质和应用-高中化学苏教2019版必修第一册四川省雅安中学2020-2021学年高一下学期4月月考化学试题黑龙江省黑河市嫩江市高级中学等部分学校2021-2022学年高一下学期第一次月考化学试题
名校
3 . 在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是
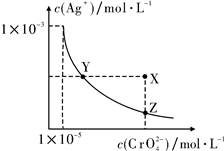

| A.T ℃时,Ag2CrO4的Ksp为1×10-11 |
| B.T ℃时,Y点和Z点的Ag2CrO4的Ksp相等 |
| C.T ℃时 , X点的溶液不稳定,会自发转变到Z点 |
| D.T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀 |
您最近一年使用:0次
2018-02-06更新
|
482次组卷
|
5卷引用:江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题
名校
4 . 某温度下,向10mL 0.1mol/LCuSO4溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]
A.Na2S溶液呈碱性,是因为S2-离子发生了水解,用离子方程式可表示为:S2-+2H2O H2S+2OH- H2S+2OH- |
| B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) |
| C.向100mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Zn2+先沉淀 |
| D.该温度下Ksp(CuS)=4×10-36 |
您最近一年使用:0次
2018-01-26更新
|
460次组卷
|
2卷引用:江西省井冈山市宁冈中学2021-2022学年高三下学期开学考试化学试题
2011·山东济南·一模
名校
5 . 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17。下列叙述中正确的是
| A.常温下,AgCl 在NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.将0.001mol·L-1的AgNO3溶液滴入KC1和KI 的混合溶液中,一定先析出AgI 沉淀 |
| C.向AgCl的悬浊液中加入少量KI 溶液,沉淀由白色转化为黄色 |
| D.向AgCl饱和溶液中加入NaCl晶体,有AgC1析出且溶液中c(Ag+)=c(C1-) |
您最近一年使用:0次
2018-01-18更新
|
202次组卷
|
19卷引用:江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题
江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题(已下线)2011届山东省济南市高三教学质量调研(一模)化学试卷(已下线)2011-2012学年福建省永定一中高二下学期第一次阶段考化学试卷(已下线)2013届安徽省怀宁中学高三上学期开学水平检测考试化学试卷(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷2015-2016学年江西省赣州市高二上学期期末考试化学试卷2016届安徽省蚌埠市高三上学期第一次教学质检化学试卷2015-2016学年四川省雅安市高二下学期期末化学试卷宁夏吴忠中学2017-2018学年高二上学期期末考试化学试题宁夏吴忠市吴忠中学2017-2018学年第一学期高二化学期末考试试卷吉林省吉林地区普通高中友好学校联合体2017-2018学年高二上学期期末考试化学试题江西省抚州市临川第一中学2019-2020学年高二下学期第十次周测化学试题四川省达州市渠县中学2018-2019学年高二下学期化期中考试化学试题青海省湟川中学2019-2020学年高二上学期期中考试化学试题第25届(2011年)高中生化学竞赛(河北赛区)初赛试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题四川省广安第二中学校2023-2024学年高二上学期第二次月考化学试题湖南省衡阳县第四中学2023-2024年高二上学期期中考试化学B卷
6 . 25℃,已知KSp(AgCl)=1.8×10-10,将2×10-5mol/L的AgNO3溶液和2×10-5mol/L的KCl溶液等体积混合,下列说法正确的是
| A.恰好形成AgCl饱和溶液 | B.能析出AgCl沉淀 |
| C.不能析出AgCl沉淀 | D.无法确定能否析出AgCl沉淀 |
您最近一年使用:0次
2017-12-14更新
|
233次组卷
|
3卷引用:江西省吉安县第三中学2017-2018学年高二1月月考化学试题
江西省吉安县第三中学2017-2018学年高二1月月考化学试题河北省邯郸三中2017-2018学年高二上学期第二次月考化学试卷(已下线)黄金30题系列++高二化学(选修4)++++小题好拿分【基础版】
7 . 下列有关电解质溶液的叙述正确的是
| A.室温下,pH均为4的H2SO4、(NH4)2SO4的溶液中,水的电离程度相同 |
| B.室温时,Ka=1×10-5浓度为0.1 mol/L的HA溶液,pH≈3 |
C.在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液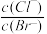 增大 增大 |
| D.25℃时,向20 mL 0.01 mol/L的醋酸溶液中滴加10 mL 0.01 mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)<c(CH3COOH) + c(OH-) |
您最近一年使用:0次
2017-06-01更新
|
525次组卷
|
4卷引用:江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题
8 . 下列实验目的对应的实验操作和实验原理均正确的是
| 实验目的 | 实验操作 | 实验原理 | |
| A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+ 2Fe(OH)3+3Mg2+ 2Fe(OH)3+3Mg2+ |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 【选修2:化学与技术】
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是____________ ;
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的_________ 极;Ⅰ口排出的是__________ (填“淡水”或“浓水”).
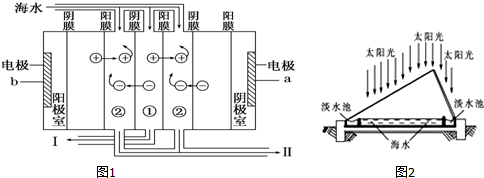
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是_____________ ;
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为______________ (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_________________ ;
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经_____ 反应得到的.自来水与该离子交换树脂交换作用后显_________ (填“酸性”、“碱性”或“中性”).

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由__________ (填阴离子符号)引起的,经___________ (填操作名称)后可被去掉.永久硬水的硬度可由离子交换法去掉。
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的

(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和
 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由
您最近一年使用:0次
名校
10 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是_____________ (用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________ 。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)_______________ c(A2-)(填“>”、“<”或“=”)
②作出上述判断的依据是_____________ (用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
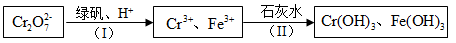
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________ 。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=___________ 。{Ksp[Cr(OH)3]=6.0×10-31}
(1)生活中明矾常作净水剂,其净水的原理是
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)
②作出上述判断的依据是
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
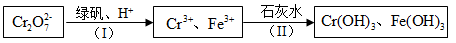
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=
您最近一年使用:0次
2016-12-09更新
|
563次组卷
|
4卷引用:江西省吉水县第二中学2020-2021学年高二上学期期中考试化学试题



