2021高三·山东·专题练习
名校
解题方法
1 . 氧化钪(Sc2O3)是一种稀土氧化物,广泛地应用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为TiO2、FeO、Fe2O3,还含有Mg、Si、Sc等元素,从钛铁矿中提取Sc2O3的流程如图:
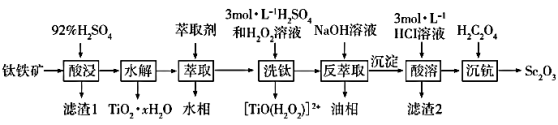
已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是___________ 。
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
___________ 。
(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为___________ ,H2O2还起到的作用是___________ 。
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是___________ 。
(5)加草酸“沉钪”的离子方程式为___________ ,获得Sc2O3的实验操作方法是___________ 。

已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是

(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是
(5)加草酸“沉钪”的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 回收利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。从废旧铅蓄电池的铅膏中回收铅的生产流程如下图(部分产物已略去)。
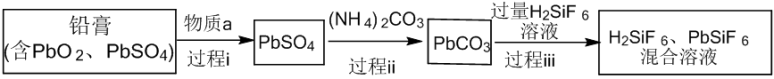
已知: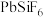 和
和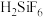 均为能溶于水的强电解质。下列说法正确的是
均为能溶于水的强电解质。下列说法正确的是

已知:
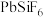 和
和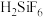 均为能溶于水的强电解质。下列说法正确的是
均为能溶于水的强电解质。下列说法正确的是| A.物质a表现氧化性 |
B. 易溶于水 易溶于水 |
C.过程iii发生反应的离子方程式为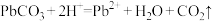 |
| D.过程i、过程ii、过程iii中均有气体生成 |
您最近一年使用:0次
2021-10-11更新
|
310次组卷
|
6卷引用:江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
名校
解题方法
3 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 制备Fe(OH)3胶体 | 将FeCl3溶液加入稀氨水中并加热煮沸 |
| B | 比较Cu(OH)2、Mg(OH)2溶解度的大小 | 向10mL0.1mol/LNaOH溶液中先加入1mL0.1mol/LMgCl2溶液,再加入1mL0.1mol/LCuCl2溶液 |
| C | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
| D | 比较碳酸和硅酸的酸性强弱 | 石灰石与浓盐酸混合共热,将所得气体通入硅酸钠溶液中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-10-09更新
|
196次组卷
|
5卷引用:江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题黑龙江省青冈县第一中学校2022届高三上学期第一次模拟考试化学试题吉林省长春市第二十九中学2022届高三上学期第二次质量检测化学试题(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14
解题方法
4 . 某探究小组设计如下线路处理废液和资源回收:
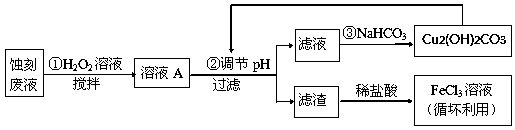
(1)用少量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:___________ 。
(2)FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:___________ 。
(3)步骤①中加入H2O2溶液的目的是:___________ 。
(4)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是:___________ 。
(5)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:___________ ,该过程中调节溶液的pH为5,则c(Fe3+)为:___________ mol·L-1.(已知:Ksp[Fe(OH)3]= 3.80×10-38)

(1)用少量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:
(2)FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:
(3)步骤①中加入H2O2溶液的目的是:
(4)已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.3 |
根据表中数据推测调节pH的范围是:
(5)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
5 . MSO4和MCO3是两种难溶性盐。常温时两种物质的溶解度曲线如图所示,下列叙述错误的是
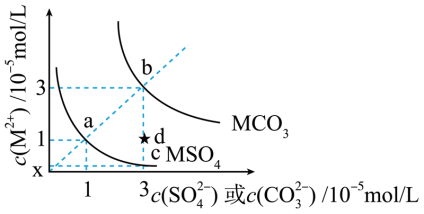
| A.Ksp(MCO3)=9.0×10−10 |
| B.c点的纵坐标0.33 |
| C.在饱和的MCO3澄清溶液里加入适量的Na2SO4固体,可使b点变为d点 |
| D.使1L含1molMSO4的悬浊液中的分散质完全转化为MCO3,需要加1molNa2CO3固体 |
您最近一年使用:0次
2021-03-03更新
|
903次组卷
|
7卷引用:江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)T13-溶液中的离子平衡(已下线)云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题
6 . 测定溶液中Cl-的浓度时,常用标准AgNO3溶液滴定,K2CrO4作指示剂。根据如下关于AgCl、Ag2CrO4的溶度积图,判断下列说法正确的是


| A.P点时,二者的溶度积常数相同 |
| B.M点时,对AgCl溶液而言为饱和状态,对Ag2CrO4溶液而言为过饱和状态 |
C.向c(Cl-)=c( )=1×10-2 mol·L-1的混合溶液中逐滴滴加1×10-3 mol·L-1 AgNO3溶液,振荡,先产生AgCl沉淀,当溶液中c(Cl-)降至1×10-5 mol·L-1时,c( )=1×10-2 mol·L-1的混合溶液中逐滴滴加1×10-3 mol·L-1 AgNO3溶液,振荡,先产生AgCl沉淀,当溶液中c(Cl-)降至1×10-5 mol·L-1时,c( )=1×10-3.5 mol·L-1 )=1×10-3.5 mol·L-1 |
D.向c(Cl-)=c( )=1×10-8.5 mol·L-1的混合溶液中逐滴滴加1×10-1 mol·L-1 AgNO3溶液,振荡,先产生Ag2CrO4沉淀 )=1×10-8.5 mol·L-1的混合溶液中逐滴滴加1×10-1 mol·L-1 AgNO3溶液,振荡,先产生Ag2CrO4沉淀 |
您最近一年使用:0次
7 . NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:

(1)为提高废渣的浸出率,可采取的措施是__ (答2点);“酸浸”与“酸溶”两步所使用的酸相同,为___ (填化学式)。
(2)步骤②中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为__ 。
(3)步骤③中加入足量的H2O2,理由是__ 。调节滤液Ⅱ的pH,可除去的金属离子是__ 。
(4)滤液Ⅲ中加入Na2CO3过滤后得到NiCO3固体,检验Ni2+已完全沉淀的实验方法是__ 。
(5)④⑤两步操作的目的是__ 。
(6)经过“一系列操作”可得到NiSO4•6H2O晶体,其中具体操作包括__ 、__ 、过滤、洗涤、干燥等。如果得到产品的纯度不够,则还应该进行__ 操作(填序号)。
a.蒸馏 b.分液 c.重结晶 d.过滤

(1)为提高废渣的浸出率,可采取的措施是
(2)步骤②中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为
(3)步骤③中加入足量的H2O2,理由是
(4)滤液Ⅲ中加入Na2CO3过滤后得到NiCO3固体,检验Ni2+已完全沉淀的实验方法是
(5)④⑤两步操作的目的是
(6)经过“一系列操作”可得到NiSO4•6H2O晶体,其中具体操作包括
a.蒸馏 b.分液 c.重结晶 d.过滤
您最近一年使用:0次
8 . I.通过计算回答下列有关沉淀溶解平衡的问题。
向50mL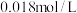 的
的 溶液中加入50mL
溶液中加入50mL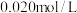 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的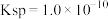 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:
(1)两溶液充分混合后溶液的
_______ 。
(2)完全沉淀后,溶液中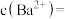
_______ 。
Ⅱ.亚氯酸钠( )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,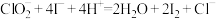 、
、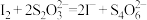 )
)
(1)达到滴定终点时的现象为_______ 。
(2)下列滴定过程中测量结果偏高的是( )
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中 的质量分数为
的质量分数为_______ (用含m、c、V的代数式表示)。
向50mL
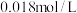 的
的 溶液中加入50mL
溶液中加入50mL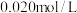 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的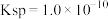 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:(1)两溶液充分混合后溶液的

(2)完全沉淀后,溶液中
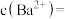
Ⅱ.亚氯酸钠(
 )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L
 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,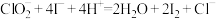 、
、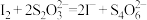 )
)(1)达到滴定终点时的现象为
(2)下列滴定过程中测量结果偏高的是
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
9 . 下列说法中,正确的是
| A.难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 |
| B.难溶电解质都是弱电解质 |
C.在白色ZnS沉淀上滴加 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 |
| D.AgCl在水中的溶解度与在饱和NaCl溶液中的溶解度相同 |
您最近一年使用:0次
2021-01-28更新
|
754次组卷
|
7卷引用:江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题
江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)课前-3.4.2 沉淀溶解平衡的应用-课前、课中、课后(人教版2019选择性必修1)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)新疆昌吉州行知学校2021-2022学年高二上学期期末考试化学试题3.4.2沉淀溶解平衡原理的应用 课后吉林省普通高中友好学校联合体2023-2024学年高二上学期期中联考化学试题
10 . 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s) Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为__ ;该反应的平衡常数表达式为__ 。
(2)对于上述反应,实验证明增大CO 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
①升高温度,平衡常数K将__ 。
②增大CO 的浓度,平衡常数K将
的浓度,平衡常数K将__ 。
已知:SrSO4(s)
 Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7SrCO3(s)
 Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO
 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。①升高温度,平衡常数K将
②增大CO
 的浓度,平衡常数K将
的浓度,平衡常数K将
您最近一年使用:0次



