名校
1 . 下列有关实验操作的解释或结论正确的是
| 实验操作 | 解释或结论 | |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2 固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 加热石蜡油,将产生的气体通入酸性高锰酸钾,溶液褪色 | 证明反应一定生成了乙烯 |
| C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果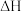 偏大 偏大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是

| A.曲线Ⅱ表示MnS的沉淀溶解平衡曲线 |
| B.升高温度,曲线Ⅱ上的c点可沿虚线平移至e点 |
C.常温下,反应MnS(s)+Fe2+(aq) FeS(s)+Mn2+(aq)的平衡常数K≈4×104 FeS(s)+Mn2+(aq)的平衡常数K≈4×104 |
| D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿Ⅰ线向a点方向移动 |
您最近一年使用:0次
2022-03-29更新
|
701次组卷
|
7卷引用:江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题
名校
3 . 室温下进行下列实验,根据实验操作和现象,所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 乙醇钠的水溶液呈强碱性 | C2H5O-结合H+的能力强 |
| B | 将某黄色溶液滴在KI淀粉试纸上,试纸变蓝 | 原溶液中一定含有Cl2 |
| C | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 酸性:碳酸强于苯酚 |
| D | 向盛有2mL一定浓度的Na3[Ag(S2O3)2]溶液的试管中,滴入5滴2mol•L-1的KI溶液,产生黄色沉淀 | [Ag(S2O3)2]3-具有较强的还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度小于水解程度 在水中的电离程度小于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 向浓度均为0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 | 产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-16更新
|
683次组卷
|
8卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题
江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题广东省梅州市兴宁市沐彬中学2021-2022学年高二下学期期中考试化学试题
5 . 关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| B.已知25℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=4.0×104 |
| C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]>Ksp(CaSO4) |
| D.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1 |
您最近一年使用:0次
2022-03-10更新
|
491次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题
名校
6 . 为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是
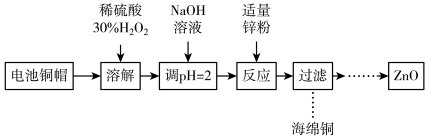

| A.“溶解” 操作中溶液温度不宜过高 |
| B.铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2 |
| C.过滤后滤液中只有ZnSO4 |
| D.本流程涉及置换反应 |
您最近一年使用:0次
2022-03-03更新
|
83次组卷
|
3卷引用:江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题
解题方法
7 . 新一代脱硝催化剂(SCR)(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
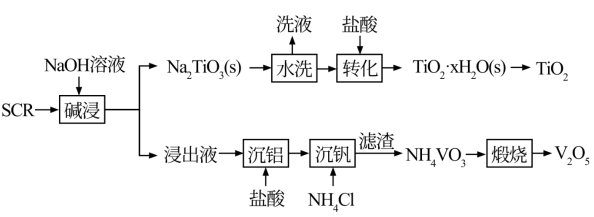
已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有___________ (写出一种措施即可)。
(2)“沉铝”过程中得到的沉淀主要成分是___________ (填化学式)
(3)“转化”时的离子方程式为___________ 。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是___________ 。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为___________ (溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全)。
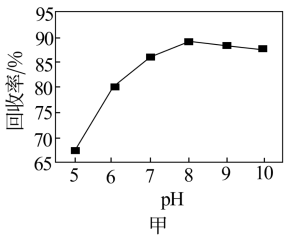
(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:___________ 。
(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为___________
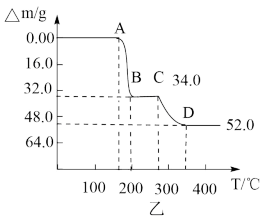

已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有
(2)“沉铝”过程中得到的沉淀主要成分是
(3)“转化”时的离子方程式为
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:

(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为

您最近一年使用:0次
8 . 根据下列实验操作和现象所得结论正确的是
| 实验操作和现象 | 实验结论 | |
| A. | 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 | HNO2电离出的H+的能力比CH3COOH的强 |
| B. | 向麦芽糖溶液中加入稀硫酸并加热,再调节pH呈酸性,再加入银氨溶液,水浴加热,有银镜产生 | 麦芽糖发生水解 |
| C. | 将镀层破损的镀锌铁皮浸泡在食盐水中,一段时间后加入K3[(CN)6]溶液,无明显现象 | 没有发生原电池反应 |
| D. | 向2ml0.1mol。L-1NaOH溶液中加入2 ml0.1mol·L-1MgCl2溶液,产生白色沉淀,再加入几滴0.1mol·L-1FeCl3溶液,产生红褐色沉淀 | Mg(OH)2沉淀可以转化为Fe (OH)3沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 两块相同的未经打磨的铝片,相同温度下分别投入5.0mL等浓度的 溶液和 溶液和 溶液中 溶液中 | 前者无明显现象,后者剧烈反应 |  能加速破坏铝片表面的氧化膜 能加速破坏铝片表面的氧化膜 |
| B | 向 溶液中加入足量NaCl后再加入少量NaI溶液 溶液中加入足量NaCl后再加入少量NaI溶液 | 白色沉淀转化为淡黄色沉淀 | 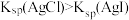 |
| C | 取少量溶液于试管中,先加入KSCN溶液,再滴加过量酸性高锰酸钾溶液 | 溶液变红色 | 溶液中含Fe2+ |
| D | 向铜与浓硫酸反应后的溶液中加入适量水稀释 | 溶液呈蓝色 | 溶液中存在 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-21更新
|
894次组卷
|
2卷引用:江西省宜春市丰城市2022-2023学年高二上学期期中考试化学试题
名校
10 . 常温下,实验测得0.1mol·L-1下列物质的溶液pH如表所示:
(1)Na2CO3溶液显碱性的主要原因为____ (用离子方程式表示)。
(2)上述CH3COONH4溶液中c(NH )
)____ NH4Cl溶液中c(NH )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。
(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=____ 。
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:____ 。
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:___ 。
物质 | Na2CO3 | CH3COONa | NaHCO3 | CH3COONH4 | NH4Cl |
溶液pH | 11 | 8.9 | 8.3 | 7.0 | a |
(2)上述CH3COONH4溶液中c(NH
 )
) )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:
您最近一年使用:0次
2022-01-18更新
|
121次组卷
|
2卷引用:江西省宜春市丰城中学2023-2024学年高二下学期3月月考化学试题



