2013·河南郑州·二模
1 . Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba( FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如图:
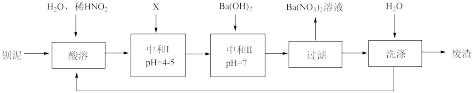
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③Ksp(BaSO4)=1.lxl0-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:_______ 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:_______ 。
(3)该厂结合本厂实际,选用的X为_______(填序号);
(4)中和I使溶液的pH为4~5目的是_______ ;结合离子方程式简述原理_______ 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是_______ 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为_______ 。

又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③Ksp(BaSO4)=1.lxl0-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
(3)该厂结合本厂实际,选用的X为_______(填序号);
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为
您最近一年使用:0次
2016-12-09更新
|
1068次组卷
|
3卷引用:2016届江西省上高二中高三全真模拟理综化学试卷
2 . 现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
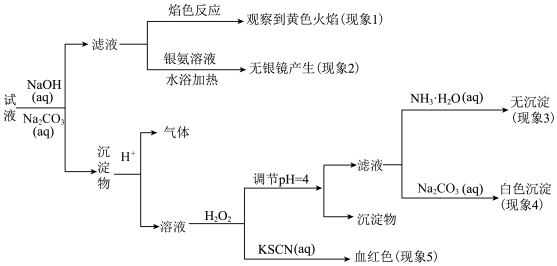
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )。

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )。
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
您最近一年使用:0次
2016-12-09更新
|
3776次组卷
|
26卷引用:江西省丰城市第九中学2021-2022学年高三上学期9月月考化学试题
江西省丰城市第九中学2021-2022学年高三上学期9月月考化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷)(已下线)2013-2014河南省商丘市高三第三次模拟考试理综化学试卷2014-2015学年湖北省武汉市第二中学高一下期末化学试卷湖南省双峰县一中、邵东县一中、邵阳市一中、邵阳市二中、武冈县二中、隆回县一中2017-2018学年高二优生1月联考化学试题福建省三明市第一中学2018届高三上学期第二次月考化学试题浙江省杭十四中2018年高三化学选考3月考试试题卷(1)(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】湖南省岳阳县第一中学2019届高三上学期期中考试化学试题上海市黄浦区2016届高三4月第二次模拟考试化学试题2019-2020学年高三化学二轮复习选择题强化训练:实验选择题训练(三)——叙述类实验山西省太原市第二十一中学2020届高三上学期期中考试化学试题020届高三化学实验复习——物质分离、提纯的常用化学方法选择【选择突破26题】湖北省武汉市部分学校2021届高三起点质量检测化学试题(已下线)小题必刷16 金属元素为载体的化工流程选择题——2021年高考化学一轮复习小题必刷(通用版)北京市人大附中2021届高三10月月考化学试题北京市第一七一中学2021届高三上学期10月月考化学试题甘肃省白银市会宁县第四中学2021届高三上学期第二次月考化学试题重庆市2021届高三上学期第二次预测性考试化学试题福建省福清西山学校高中部2021届高三上学期期中考试化学试题黑龙江省实验中学2021届高三上学期12月月考化学试题河北正定中学2022届高三第四次月考化学试题(已下线)专题04.离子反应-十年(2012-2021)高考化学真题分项汇编(浙江专用)湖南省株洲市南方中学2021-2022学年高三下学期4月月考化学试题全书综合测评2江西省南昌市2023-2024学年高三上学期11月期中三校联考化学试题
11-12高三·江西·阶段练习
名校
解题方法
3 . 下列图示与对应的叙述相符的是
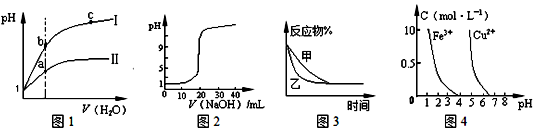

| A.图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强 |
| B.图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线 |
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右 |
您最近一年使用:0次
2016-12-09更新
|
1010次组卷
|
12卷引用:2015-2016学年江西省上高二中高二上12月月考化学试卷
2015-2016学年江西省上高二中高二上12月月考化学试卷(已下线)2013届江西省师大附中、临川一中高三8月联考化学试卷(已下线)2013届山东省德州市跃华学校高三12月月考化学试卷2016-2017学年广西陆川中学高二上9月月考化学卷安徽省安庆市第一中学2016-2017学年高二下学期期中考试化学试题江苏省苏州市2018届高三期初调研化学试题山西省康杰中学2017-2018学年高二上学期期中考试化学试题江苏省前黄高级中学、如东高级中学、姜堰中学等五校2018届高三上学期第一次学情监测化学试题安徽省合肥市第九中学2018届高三下学期第二次理综化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定的误差分析及拓展应用【懂做原理题】2020届高三化学选修4二轮专题练——酸碱中和滴定的综合考查
11-12高二上·山东济宁·期中
名校
4 . 工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
(1)溶液A中加入NaClO的目的是____________________________ ;
此反应离子方程式为_____________________________________ ;
(2)在溶液B中加入CuO的作用是______________________________ ;
(3)操作a的目的是_________________________________________ ;
(4)在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是__________ 。

请结合下表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
此反应离子方程式为
(2)在溶液B中加入CuO的作用是
(3)操作a的目的是
(4)在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是
您最近一年使用:0次
2016-12-09更新
|
698次组卷
|
3卷引用:2016-2017学年江西省奉新县第一中学高二下学期第一次月考化学试卷
2016-2017学年江西省奉新县第一中学高二下学期第一次月考化学试卷(已下线)2011-2012学年山东省济宁市邹城二中高二上学期期中质量检测化学试卷2016-2017学年福建省漳州市第一中学高二上学期期末考试化学试卷
10-11高一上·江西宜春·期中
解题方法
5 . (1)Na2SO3溶液蒸干得到的固体物质是___________ ,原因是_____ .
(2)碳酸氢钡溶液蒸干得到的固体物质是___________ ,原因是_________ .
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为_________ ,原因是_____________________________________ 。
(4)与c(H+)·c(OH-)=Kw类似,FeS饱和溶液中存在:FeS(s) Fe
Fe
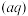 +S
+S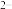
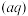 ,c(Fe
,c(Fe )·c(s
)·c(s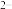 )=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
)=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为___________________ 。
(2)碳酸氢钡溶液蒸干得到的固体物质是
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为
(4)与c(H+)·c(OH-)=Kw类似,FeS饱和溶液中存在:FeS(s)
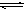 Fe
Fe
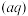 +S
+S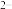
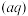 ,c(Fe
,c(Fe )·c(s
)·c(s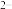 )=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
)=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
您最近一年使用:0次
6 . 已知:25°C时, ,
, 。下列说法正确的是
。下列说法正确的是
 ,
, 。下列说法正确的是
。下列说法正确的是A.25°C时,饱和 溶液与饱和 溶液与饱和 溶液相比,前者的 溶液相比,前者的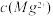 大 大 |
B.25°C时,在 的悬浊液加入少量的 的悬浊液加入少量的 固体, 固体,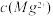 增大 增大 |
C.25°C时, 固体在20ml0.01 mol· 固体在20ml0.01 mol·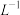 氨水中的 氨水中的 比在20mL0.01mol· 比在20mL0.01mol·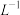  溶液中的 溶液中的 小 小 |
D.25°C时,在 的悬浊液加入 的悬浊液加入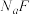 溶液后, 溶液后, 不可能转化成为 不可能转化成为 |
您最近一年使用:0次
2016-12-09更新
|
1389次组卷
|
78卷引用:江西省靖安中学2020-2021学年高二上学期第二次月考化学试题
江西省靖安中学2020-2021学年高二上学期第二次月考化学试题2009年普通高等学校招生统一考试理综试题化学部分(浙江卷)(已下线)2010年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2011届安徽省阜阳三中高三上学期期末考试化学试卷(已下线)2010—2011学年江苏省盐城中学高二第二学期期末考试化学试卷(已下线)2011-2012学年黑龙江省大庆铁人中学高二上学期第二阶段测试化学试卷(已下线)2011-2012学年吉林省东北师大附中高二上学期期末考试化学试卷(已下线)2011-2012学年河北唐山市第一中学高二年级调研考试化学试卷(已下线)2011-2012学年吉林省长春市十一高中高二上学期期末考试化学试卷(已下线)2011-2012年陕西宁强天津中学高二下学期期中考试化学试卷(已下线)2011-2012学年江西省白鹭洲中学高二下学期第三次月考化学试卷(已下线)2011-2012学年浙江省浙东北三校高二下学期期中联考化学试卷(已下线)2013-2014学年吉林省白山市第一中学高二上学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 17难溶电解质的溶解平衡练习卷(已下线)2012届吉林东北师大附中高二上学期期末考试化学试卷 (已下线)2014届山东济南外国语学校高三上学期质量检测化学试卷 (已下线)2014~2015学年黑龙江省哈六中高二上学期期中化学试卷2014-2015辽宁省沈阳二中高二上学期12月月考化学试卷2014-2015河南省陕州中学高二下学期第二次精英对抗赛化学试卷2015届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷2015-2016学年吉林省吉林一中高二上期中考试化学试卷2015-2016学年甘肃省天水一中高二上学期第一次段中考试化学试卷2015-2016学年山西省怀仁一中高二上11月月考化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷2015-2016学年山东省枣庄三中高二上学情调查化学试卷2016届河北省冀州中学高三上学期第四次月考化学试卷2015-2016学年山西省曲沃中学高二上学期12月月考化学试卷2015-2016学年湖南省张家界民族中学高二上学期12月月考化学试卷2015-2016学年河南省南阳市高二上学期期终质量评估化学试卷2015-2016学年黑龙江大庆一中高二下假期验收化学试卷2015-2016学年江西吉安一中高二下第二次段考化学试卷2015-2016学年山西省临汾一中高二5月月考化学试卷2016-2017学年陕西省西安长安区一中高二上期中化学卷2016-2017学年河北省邢台市高二上学期第四次月考化学卷2016-2017学年江西省南昌市第二中学高二上学期期末考试化学试卷广西桂林市桂林中学2016-2017学年高二下学期期中考试化学试题河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第二次月考化学试题吉林省延边第二中学2017-2018学年高二上学期第二次月考化学试题宁夏育才中学勤行校区2017-2018学年高二12月月考化学试题重庆市第一中学2017-2018学年高二上学期期中考试化学试题湖南省师范大学附属中学2017-2018学年高二上学期期末考试化学(理)试题【全国市级联考】黑龙江省齐齐哈尔市2017-2018学年高二下学期期末考试化学试题1【全国市级联考】黑龙江省齐齐哈尔市2017-2018学年高二下学期期末考试化学试题2(已下线)2018年11月19日 《每日一题》人教选修4-沉淀的转化河南省上蔡县第二高级中学2018-2019学年高二上学期期中考试化学试题河北省黄骅中学2018-2019学年高二上学期第二次月考化学试题山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题安徽省滁州市明光中学2019-2020学年高二上学期第一次月考化学试题黑龙江省伊春市第二中学2019-2020学年高二上学期期中考试化学(理)试题苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷安徽省合肥市肥东县第二中学2019-2020学年高二上学期第二次月考化学试题(普通班)宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期第二次月考化学试题安徽省涡阳县第一中学2019-2020学年高二12月月考化学试题重庆市黔江新华中学校2019-2020学年高二12月月考化学试题云南省丽江市宁蒗县第一中学2019—2020学年高二上学期期末考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)河南省焦作市沁阳市第一中学2019-2020高二月考考试化学试题黑龙江省伊春林业管理局第二中学2019-2020学年高二下学期期中质量检测化学试题江苏省常熟市2019-2020学年高二下学期期中考试化学试题福建省福州福清市2017-2018学年高二上学期期末考试化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下学期期末考试化学试题(已下线)第21讲 难溶电解质的溶解平衡-2021年高考化学一轮复习名师精讲练黑龙江省大兴安岭漠河县高级中学2019-2020学年高二上学期期中考试化学试题甘肃省兰州市第一中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)清远市2016-2017学年度第一学期期末教学质量检测高二化学试题(已下线)3.4.2 沉淀溶解平衡原理的应用(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)黑龙江省实验中学2020-2021学年高三上学期期中考试化学试题陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题江苏省宜兴市张渚高级中学2020-2021学年高二下学期期中考试化学试题(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)3.4.1 难溶电解质的沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)3.4.1 沉淀溶解平衡原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)内蒙古彦淖尔市临河区第三中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高二上学期期中考试化学试题(已下线)题型139 沉淀溶解平衡及其影响因素上海市上海中学2023-2024学年高二上学期期中考试化学试题
名校
7 . 下列说法正确的是
| A.用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液 |
| B.在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 |
| C.反应SiO2(s)+ 3C(s)="SiC(s)" + 2CO(g)室温下不能自发进行,则该反应的△H<0 |
| D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
您最近一年使用:0次
2016-05-30更新
|
166次组卷
|
3卷引用:江西省高安二中2018-2019学年高二上学期期中考试化学试题
名校
8 . 25 ℃时,三种难溶银盐的Ksp与颜色如表所示,下列说法正确的是
| AgCl | Ag2CrO4 | AgI | |
| 颜色 | 白色 | 砖红色 | 黄色 |
| Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
| A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小 |
| B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6 mol·L-1 |
| C.向AgCl悬浊液上加入足量KI溶液,沉淀将由白色转化为黄色 |
| D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀 |
您最近一年使用:0次
2015-01-28更新
|
670次组卷
|
10卷引用:江西省奉新县第一中学2017-2018学年高二上学期第二次月考化学试题
江西省奉新县第一中学2017-2018学年高二上学期第二次月考化学试题2014-2015福建省厦门市高三上学期期末质量检查化学试卷【全国百强校】新疆实验中学2018-2019学年高二上学期期末考试化学试题(已下线)练习12 难溶电解质的溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)河北省衡水市第十四中学2020-2021学年高二上学期期末考试化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题辽宁省大连市一0三中学2021-2022学年高二上学期期中考试化学试题重庆市西南大学附属中学校2021-2022学年高一广延班下学期期末考试化学试题第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用
真题
名校
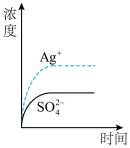
9 . 已知Ag2SO4的Ksp为2.0×10-5 mol3·L-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+ 和SO42-浓度随时间变化关系如右图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol•L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol•L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+ 和SO42-浓度随时间变化关系的是

A. | B. | C.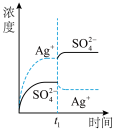 | D.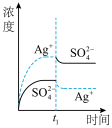 |
您最近一年使用:0次
2009-11-23更新
|
1908次组卷
|
17卷引用:江西省宜春中学 高安二中 上高二中 樟树中学 丰城中学五校2021届高三上学期联考化学试题
江西省宜春中学 高安二中 上高二中 樟树中学 丰城中学五校2021届高三上学期联考化学试题2008年普通高等学校招生统一考试化学试题(广东卷)(已下线)2012届浙江省浙南、浙北部分学校高三12月联考化学试卷2016届福建省福州一中高三下质检理综化学试卷(已下线)同步君 选修4 第3章第4节 难溶电解质的溶解平衡2015—2016学年河南省郑州一中高二上学期期末考试化学试卷宁夏石嘴山市第三中学2016-2017学年高二下学期第二次(5月)月考化学试题2018届高三一轮复习化学:微考点64-沉淀溶解平衡高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡福建省三明市第一中学2017-2018学年高二下学期开学考试化学试题陕西省西安市铁一中学2019—2020学年高三上学期第四次月考化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算四川省成都列五中学2019-2020学年高三下学期第四次阶段性考试化学试题云南省保山市第九中学2020-2021学年高二上学期质量检测化学试题浙江省金华第一中学2021-2022学年高一上学期领军班期末联考化学试题浙江省金华一中(领军班)2021-2022学年高一上学期期末化学试题黑龙江省哈尔滨市第六中学2022-2023学年高三8月月考化学试题



