名校
1 . 25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是


A.a点溶液满足:c(NH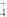 )>c(NH3·H2O)>c(Mg2+)>c(OH-) )>c(NH3·H2O)>c(Mg2+)>c(OH-) |
| B.b点溶液中无Mg(OH)2沉淀产生 |
C.c点溶液满足:2c(Mg2+)+c( )>c(Cl-) )>c(Cl-) |
| D.Ksp[Mg(OH)2]的数量级是10-12 |
您最近一年使用:0次
2022-10-27更新
|
427次组卷
|
3卷引用:江西省宜春市第一中学2022-2023学年高二上学期期末考试化学试题
2 . NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
(1)向滤液Ⅰ中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为___________ ,当c(Cu2+)≤1.0×10-5mol•L-1时,可认为Cu2+已沉淀完全,此时溶液中S2-的浓度不小于___________ 。(已知:Ksp(CuS)=6.3×10-36)
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是___________ 。
②调节滤液Ⅱ的pH,pH应控制在范围___________ 。
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是___________ 。
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___________ 。

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 2.2 | 3.2 |
| Ni2+ | 6.4 | 8.4 |
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是
②调节滤液Ⅱ的pH,pH应控制在范围
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2022-09-26更新
|
251次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
3 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 向溶液X中滴加浓盐酸,将产生气体通入品红溶液,溶液褪色 | 证明溶液X中含有 或 或 |
| B | 室温下,向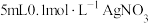 溶液中加入几滴 溶液中加入几滴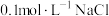 溶液出现白色沉淀,再滴加几滴 溶液出现白色沉淀,再滴加几滴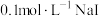 溶液,出现黄色沉淀 溶液,出现黄色沉淀 | 证明相同温度下: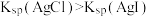 |
| C | 常温下,测得相同浓度溶液的 : : | 证明常温下的水解程度: |
| D | 将 溶液滴入酸性 溶液滴入酸性 溶液中,紫红色褪去 溶液中,紫红色褪去 | 证明 有还原性 有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-02更新
|
1369次组卷
|
4卷引用:江西省新余市2022-2023学年高二上学期期末质量检测化学试题
4 . 下列事实不能用勒夏特列原理解释的是
A.石蕊(HZ)可发生电离:HZ(红色)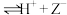 (蓝色),可用作酸碱指示剂 (蓝色),可用作酸碱指示剂 |
B.由 、 、 、HI(g)组成的平衡体系,加压后颜色变深 、HI(g)组成的平衡体系,加压后颜色变深 |
| C.黄绿色的氯水光照后颜色变浅 |
D.用 溶液将锅炉水垢中的 溶液将锅炉水垢中的 转化为 转化为 |
您最近一年使用:0次
解题方法
5 . 下列有关实验操作和现象与结论对应关系正确的是
| 选项 | 操作和现象 | 结论 |
| A | 向 溶液中加入足量硝酸,将产生的气体通入 溶液中加入足量硝酸,将产生的气体通入 溶液中,产生白色沉淀 溶液中,产生白色沉淀 | 非金属性:N>C>Si |
| B | 向酸性 溶液中滴加丙烯醇( 溶液中滴加丙烯醇(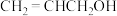 )并振荡,溶液褪色。 )并振荡,溶液褪色。 | 丙烯醇中含有醇羟基 |
| C | 向某待测液中滴加少量 ,再加入几滴KSCN溶液,溶液变为血红色 ,再加入几滴KSCN溶液,溶液变为血红色 | 待测液中一定含Fe3+ |
| D | 向10滴  溶液中,先滴入 溶液中,先滴入 的NaCl溶液,至不再有白色沉淀生成。再滴入 的NaCl溶液,至不再有白色沉淀生成。再滴入 的NaI溶液,白色沉淀转化为黄色沉淀。 的NaI溶液,白色沉淀转化为黄色沉淀。 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 按要求完成下列各空:
(1)25℃时,pH=2的盐酸 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
_______ 。
(2)25℃时,在等体积的①pH=1的 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是_______ 。
(3) 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为_______ 。(填写序号)
(4)向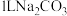 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中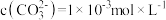 时,此时溶液中
时,此时溶液中
_______  。[已知
。[已知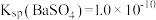 ,
,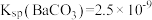 ]
]
(1)25℃时,pH=2的盐酸
 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
(2)25℃时,在等体积的①pH=1的
 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是(3)
 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为(4)向
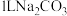 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中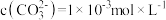 时,此时溶液中
时,此时溶液中
 。[已知
。[已知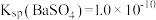 ,
,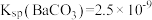 ]
]
您最近一年使用:0次
7 . 化学与人类生产、生活、可持续发展密切相关。下列说法不正确的是
| A.乙烯的产量是衡量国家石油化工发展水平的重要标志 |
| B.用明矾代替二氧化氯处理生活污水,可提高杀菌消毒效果 |
| C.牙膏中添加氟化物用于预防龋齿 |
| D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
您最近一年使用:0次
2022-06-01更新
|
100次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
8 . 常温下,几种难溶物的溶度积常数如下表所示。下列说法错误的是
| 化合物 |  |  |  |  |  |  |
 | 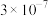 | 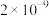 |  | 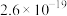 | 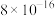 | 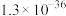 |
A.常温下,溶解度: |
B.向含同浓度的 和 和 混合溶液中滴加稀 混合溶液中滴加稀 溶液, 溶液, 先沉淀 先沉淀 |
C.向 悬浊液中加入 悬浊液中加入 溶液,无明显现象 溶液,无明显现象 |
D.反应 的平衡常数很小,反应几乎不进行 的平衡常数很小,反应几乎不进行 |
您最近一年使用:0次
9 . 氨是重要的基础化工原料,工业上常用于制备氨水、亚硝酸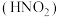 、连二次硝酸
、连二次硝酸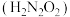 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。
(1)已知: 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为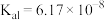 、
、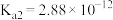 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为___________ 。
(2)常温下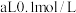 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为___________ (用含a、b的式子表示)
(3)向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中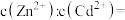
___________ 。[已知: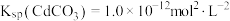 ,
,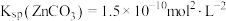 ]
]
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(4)羟基磷灰石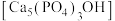 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: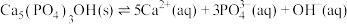 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________
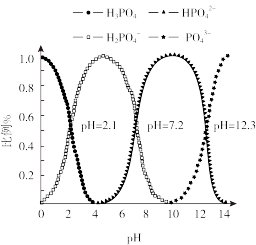
(5)常温下,向磷酸溶液中滴加 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
(6)联氨(又称联肼, 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:____________ 平衡常数值为___________ (已知: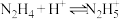 的
的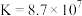 ;
;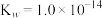 )。
)。
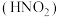 、连二次硝酸
、连二次硝酸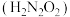 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。(1)已知:
 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为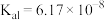 、
、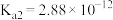 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为(2)常温下
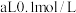 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为(3)向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中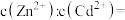
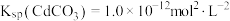 ,
,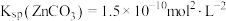 ]
]可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(4)羟基磷灰石
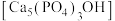 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: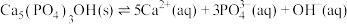 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(5)常温下,向磷酸溶液中滴加
 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
A.溶液中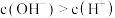 |
B. 的电离程度大于其水解程度 的电离程度大于其水解程度 |
C. c(Na+)+ c(H+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO )+c(OH—) )+c(OH—) |
| D.溶液中水的电离程度比纯水大 |
(6)联氨(又称联肼,
 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为: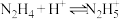 的
的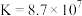 ;
;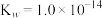 )。
)。
您最近一年使用:0次
名校
解题方法
10 . 化学与社会、生活密切相关。下列说法不正确的是
A.锅炉水垢中含有的 ,可先用 ,可先用 溶液处理,后用酸除去 溶液处理,后用酸除去 |
B.用 作沉淀剂,除去水中的 作沉淀剂,除去水中的 和 和 |
| C.疫苗一般应冷藏存放,以减小蛋白质变性的速率。 |
| D.在其他外界条件不变的情况下,汽车排气管中使用催化剂,可改变产生尾气的反应方向 |
您最近一年使用:0次



