名校
解题方法
1 . 通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下:
(1)NH4F溶液显___________ 性,保存此溶液应该放在___________ 中。
(2)NH4HCO3溶液与少量NaOH溶液反应时,___________ (填离子符号)先与 NaOH溶液中的OH-反应。
(3)①反应 CuS(s)+H2SO4(aq) H2S(aq)+CuSO4(aq)的K=
H2S(aq)+CuSO4(aq)的K=___________ ;反应 FeS(s)+H2SO4(aq) H2S(aq)+FeSO4 (aq)的K= 3.9×103;
H2S(aq)+FeSO4 (aq)的K= 3.9×103;
②反应 CuS(s)+Fe2+(aq) FeS(s)+Cu2+(aq)的K=
FeS(s)+Cu2+(aq)的K=___________ (以上计算结果均保留两位有效数字)。
③由计算结果可以知道实验室制备H2S气体应选用___________ ,检验H2S气体应选用___________ (均用上述反应中的盐类物质作答)
(4)除去废水中的Cu2+使用过量的FeS固体的优点有:
①可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;
②___________ 。
| NH3•H2O | Kb=1.8×10-5 |
| H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| HF | Ka=6.8×10-4 |
| H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| H2O | Kw=10-14 |
| Cu(OH)2 | Ksp=2.2×10-20 |
| Fe(OH)3 | Ksp=4.0×10-38 |
| CuS | Ksp=6.3×10-36 |
| FeS | Ksp=3.6×10-18 |
| 常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F溶液显
(2)NH4HCO3溶液与少量NaOH溶液反应时,
(3)①反应 CuS(s)+H2SO4(aq)
 H2S(aq)+CuSO4(aq)的K=
H2S(aq)+CuSO4(aq)的K= H2S(aq)+FeSO4 (aq)的K= 3.9×103;
H2S(aq)+FeSO4 (aq)的K= 3.9×103;②反应 CuS(s)+Fe2+(aq)
 FeS(s)+Cu2+(aq)的K=
FeS(s)+Cu2+(aq)的K=③由计算结果可以知道实验室制备H2S气体应选用
(4)除去废水中的Cu2+使用过量的FeS固体的优点有:
①可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;
②
您最近一年使用:0次
2021-02-07更新
|
317次组卷
|
2卷引用:江西师范大学附属中学2020-2021学年高二上学期期末考试化学试题
2 . NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:

(1)为提高废渣的浸出率,可采取的措施是__ (答2点);“酸浸”与“酸溶”两步所使用的酸相同,为___ (填化学式)。
(2)步骤②中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为__ 。
(3)步骤③中加入足量的H2O2,理由是__ 。调节滤液Ⅱ的pH,可除去的金属离子是__ 。
(4)滤液Ⅲ中加入Na2CO3过滤后得到NiCO3固体,检验Ni2+已完全沉淀的实验方法是__ 。
(5)④⑤两步操作的目的是__ 。
(6)经过“一系列操作”可得到NiSO4•6H2O晶体,其中具体操作包括__ 、__ 、过滤、洗涤、干燥等。如果得到产品的纯度不够,则还应该进行__ 操作(填序号)。
a.蒸馏 b.分液 c.重结晶 d.过滤

(1)为提高废渣的浸出率,可采取的措施是
(2)步骤②中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为
(3)步骤③中加入足量的H2O2,理由是
(4)滤液Ⅲ中加入Na2CO3过滤后得到NiCO3固体,检验Ni2+已完全沉淀的实验方法是
(5)④⑤两步操作的目的是
(6)经过“一系列操作”可得到NiSO4•6H2O晶体,其中具体操作包括
a.蒸馏 b.分液 c.重结晶 d.过滤
您最近一年使用:0次
名校
解题方法
3 . 室温时,下列各溶液的叙述中正确的是
A.CO2通入KOH溶液,当c(H+)水电离=10-7 mol/L时存在:c(K+)=c( )+c( )+c(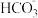 ) ) |
| B.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀 |
| C.0.1 mol/L的氨水的pH=a,0.01 mol/L的氨水的pH=b,则a-1>b |
D.NaHSO3溶液中存在:c(Na+)>c(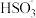 )>c(H+)>c( )>c(H+)>c( )>c(OH-) )>c(OH-) |
您最近一年使用:0次
2021-02-05更新
|
261次组卷
|
2卷引用:江西师范大学附属中学2020-2021学年高二上学期期末考试化学试题
4 . 根据下列实验操作及现象,能得出正确的结论的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A. | 向1mL2mol·L-1NaOH溶中加入2滴0.1mol·L-1MgCl2溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | 证明在相同温度下,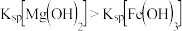 |
B. | 室温下,分别测饱和的 和 和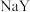 溶液的pH 溶液的pH |  和 和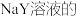 pH分别为8和9 pH分别为8和9 | 酸性: |
C. | 向2份等体积等浓度的稀硫酸中分别加入少量等物质的量的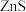 和 和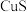 固体 固体 | 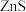 溶解而 溶解而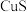 不溶解 不溶解 | 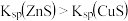 |
D. | 10mL,pH=4的HA溶液加水稀释至100mL | 稀释后溶液的pH=4.5 | HA为弱酸,该实验可 能是用pH试纸测的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-02-03更新
|
695次组卷
|
5卷引用:江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题
名校
5 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 将FeCl3饱和溶液滴加到NaOH溶液中 | 制得Fe(OH)3胶体 |
| B | 室温下,向1mL0.1mol·L-1AgNO3溶液中加入几滴0.1mol·L-1NaCl溶液出现白色沉淀,再滴加几滴0.1mol·L-1NaI溶液,出现黄色沉淀 | 证明相同温度下:Ksp(AgCl)>Ksp(AgI) |
| C | 常温下,测得相同浓度溶液的pH:NaA>NaB | 证明常温下的水解程度:A-<B- |
| D | 等体积pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-31更新
|
255次组卷
|
5卷引用:江西省赣州市2020-2021学年高二上学期期末考试化学试题
6 . 下列化学用语对事实的表述错误的是
| A.Na2S做沉淀剂可处理含Hg2+的工业污水:Hg2++S2-=HgS↓ |
| B.乙烯的燃烧热是1411.3 kJ·mol-1,则乙烯燃烧的热化学方程式为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1411.3kJ·mol-1 |
| C.P(s,白磷)=P(s,红磷) ΔH=-17.6kJ·mol-1由此推知,红磷比白磷更稳定 |
| D.闪锌矿(ZnS)经CuSO4溶液作用转化为铜蓝(Cus):ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq) |
您最近一年使用:0次
7 . I.通过计算回答下列有关沉淀溶解平衡的问题。
向50mL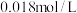 的
的 溶液中加入50mL
溶液中加入50mL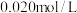 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的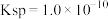 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:
(1)两溶液充分混合后溶液的
_______ 。
(2)完全沉淀后,溶液中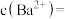
_______ 。
Ⅱ.亚氯酸钠( )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,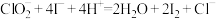 、
、 )
)
(1)达到滴定终点时的现象为_______ 。
(2)下列滴定过程中测量结果偏高的是( )
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中 的质量分数为
的质量分数为_______ (用含m、c、V的代数式表示)。
向50mL
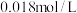 的
的 溶液中加入50mL
溶液中加入50mL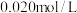 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的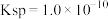 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:(1)两溶液充分混合后溶液的

(2)完全沉淀后,溶液中
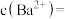
Ⅱ.亚氯酸钠(
 )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L
 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,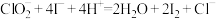 、
、 )
)(1)达到滴定终点时的现象为
(2)下列滴定过程中测量结果偏高的是
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
8 . 下列说法中,正确的是
| A.难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 |
| B.难溶电解质都是弱电解质 |
C.在白色ZnS沉淀上滴加 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 |
| D.AgCl在水中的溶解度与在饱和NaCl溶液中的溶解度相同 |
您最近一年使用:0次
2021-01-28更新
|
754次组卷
|
7卷引用:江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题
江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题新疆昌吉州行知学校2021-2022学年高二上学期期末考试化学试题(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)课前-3.4.2 沉淀溶解平衡的应用-课前、课中、课后(人教版2019选择性必修1)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)3.4.2沉淀溶解平衡原理的应用 课后吉林省普通高中友好学校联合体2023-2024学年高二上学期期中联考化学试题
解题方法
9 . 回答下列问题:
(1)对同一个反应,化学平衡常数K的大小能说明_______ ,K越大,_______ 越大;弱酸、弱碱的电离平衡常数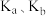 能够反映
能够反映_______ ;难溶电解质的溶度积常数 的大小反映了
的大小反映了_______ ,升高温度时,
_______ (填“增大”、“减小”或“无法判断”)。
(2)向 溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:
溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:_______ 。
(3)常温时,向浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,先生成的沉淀的颜色为
溶液,先生成的沉淀的颜色为_______ ,生成该沉淀的离子方程式为_______ 。{已知常温时,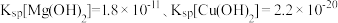 ﹜
﹜
(4)常温时,向浓度为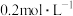 的
的 溶液中滴加同浓度的
溶液中滴加同浓度的 溶液,当恰好沉淀完全时,溶液的
溶液,当恰好沉淀完全时,溶液的
_______ 。(忽略溶液混合引起的体积变化)
(1)对同一个反应,化学平衡常数K的大小能说明
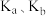 能够反映
能够反映 的大小反映了
的大小反映了
(2)向
 溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:
溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:(3)常温时,向浓度均为
 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,先生成的沉淀的颜色为
溶液,先生成的沉淀的颜色为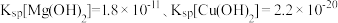 ﹜
﹜(4)常温时,向浓度为
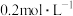 的
的 溶液中滴加同浓度的
溶液中滴加同浓度的 溶液,当恰好沉淀完全时,溶液的
溶液,当恰好沉淀完全时,溶液的
您最近一年使用:0次
2021-01-27更新
|
49次组卷
|
2卷引用:江西省抚州市2020-2021学年高二上学期学生学业水平测试化学试题
名校
解题方法
10 . 一定温度下,AgCl(s)⇌Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是


| A.a、b、c三点对应的Ksp不相等 |
| B.AgCl在c点的溶解度比b点的大 |
| C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-) |
| D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化 |
您最近一年使用:0次
2020-12-24更新
|
229次组卷
|
5卷引用:江西省上饶市2021-2022学年高二上学期期末质量检测化学试题
江西省上饶市2021-2022学年高二上学期期末质量检测化学试题山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第5讲 难溶电解质的溶解平衡山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题



