1 . 下列实验操作、现象、结论正确的是
| 操作及现象 | 结论 | |
| A | 向Al2(SO4)3溶液中滴加Na2S溶液,产生白色沉淀 | 白色沉淀成分是Al2S3 |
| B | 将50mL 0.55mol/L的NaOH溶液缓慢倒入盛有50mL 0.50mol/L的HCl溶液的烧杯中 | 测定中和热 |
| C | 向盛有2mL 0.1mol/L ZnSO4溶液的试管中加入2mL 1mol/L Na2S溶液,再加入0.1mol/L CuSO4溶液,最终得到黑色沉淀 | CuS的溶解度比ZnS小 |
| D | 向盛有0.01mol/L CH3COONa溶液的试管中滴加几滴酚酞试液,溶液变红,加热,颜色变深 | 溶液中存在水解平衡CH3COO-+H2O CH3COOH+OH-,且为吸热反应 CH3COOH+OH-,且为吸热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 新一代脱硝催化剂(SCR)(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
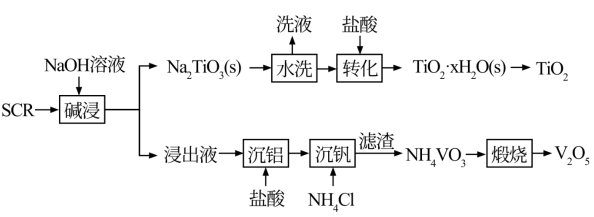
已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有___________ (写出一种措施即可)。
(2)“沉铝”过程中得到的沉淀主要成分是___________ (填化学式)
(3)“转化”时的离子方程式为___________ 。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是___________ 。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为___________ (溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全)。
(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:___________ 。
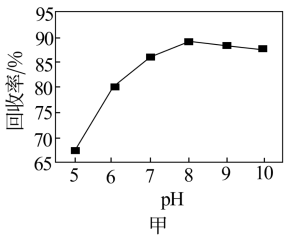
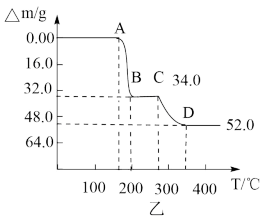
(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为___________

已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有
(2)“沉铝”过程中得到的沉淀主要成分是
(3)“转化”时的离子方程式为
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:

(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为

您最近一年使用:0次
3 . 根据下列实验操作和现象所得结论正确的是
| 实验操作和现象 | 实验结论 | |
| A. | 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 | HNO2电离出的H+的能力比CH3COOH的强 |
| B. | 向麦芽糖溶液中加入稀硫酸并加热,再调节pH呈酸性,再加入银氨溶液,水浴加热,有银镜产生 | 麦芽糖发生水解 |
| C. | 将镀层破损的镀锌铁皮浸泡在食盐水中,一段时间后加入K3[(CN)6]溶液,无明显现象 | 没有发生原电池反应 |
| D. | 向2ml0.1mol。L-1NaOH溶液中加入2 ml0.1mol·L-1MgCl2溶液,产生白色沉淀,再加入几滴0.1mol·L-1FeCl3溶液,产生红褐色沉淀 | Mg(OH)2沉淀可以转化为Fe (OH)3沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
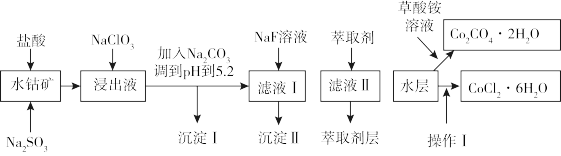
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“浸出”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2) 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为_______ 。
(3)加入 调pH至5.2,目的是
调pH至5.2,目的是_______ ;加萃取剂的目的是除去锰元素,则沉淀Ⅱ的主要成分为_______ (填化学式)。
(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,_______ 、_______ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体( )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为_______ 。(已知: 的摩尔质量为
的摩尔质量为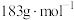 )
)
 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀pH | 3.7 | 9. 6 | 9.2 | 5.2 | 9.8 |
(1)“浸出”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(2)
 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为(3)加入
 调pH至5.2,目的是
调pH至5.2,目的是(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,
(5)将5.49g草酸钴晶体(
 )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。| 温度范围/℃ | 固体质量/g |
| 150〜210 | 4.41 |
| 290〜320 | 2.41 |
 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为 的摩尔质量为
的摩尔质量为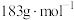 )
)
您最近一年使用:0次
5 . 测定水样中 浓度的实验步骤如下:
浓度的实验步骤如下:
①向锥形瓶中加入25.00mL处理后的水样,加入几滴 溶液;
溶液;
②加入 溶液(过量),充分摇匀;
溶液(过量),充分摇匀;
③用 标准溶液进行滴定,至终点时消耗标准溶液
标准溶液进行滴定,至终点时消耗标准溶液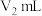 。
。
已知: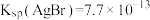 ;
; (白色),
(白色),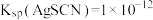 。下列说法错误的是
。下列说法错误的是
 浓度的实验步骤如下:
浓度的实验步骤如下:①向锥形瓶中加入25.00mL处理后的水样,加入几滴
 溶液;
溶液;②加入
 溶液(过量),充分摇匀;
溶液(过量),充分摇匀;③用
 标准溶液进行滴定,至终点时消耗标准溶液
标准溶液进行滴定,至终点时消耗标准溶液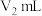 。
。已知:
 ;
; (白色),
(白色),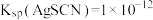 。下列说法错误的是
。下列说法错误的是| A.到达滴定终点时,溶液变为红色 |
| B.该滴定法需在酸性条件下进行 |
C.根据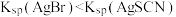 可知,反应 可知,反应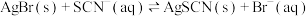 不能发生 不能发生 |
D.该水样中 的浓度 的浓度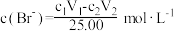 |
您最近一年使用:0次
解题方法
6 . 下列指定反应的离子方程式正确的是
A.向 溶液中通入过量 溶液中通入过量 : :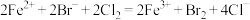 |
B.酸化 和 和 的混合溶液: 的混合溶液: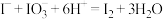 |
C.氧化亚铁溶于稀硝酸: |
D.氢氧化镁溶于氯化铵溶液: |
您最近一年使用:0次
7 . 能正确表示下列变化的离子方程式是
| A.AgCl悬浊液中滴入Na2S溶液:2Ag++S2-=Ag2S↓ |
B.氢氧化钡溶液中滴加少量硫酸氢钠溶液:Ba2++2OH-+2H++ =BaSO4↓+2H2O =BaSO4↓+2H2O |
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 =Al2(CO3)3↓ =Al2(CO3)3↓ |
| D.将标准状况下的22.4LCl2通入含2molFeI2的FeI2溶液中:Cl2+2I-=2Cl-+I2 |
您最近一年使用:0次
8 . 请回答下列问题:
(1)84消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈___________ 性(填“酸”“碱”或“中”),原因可用离子方程式表示为___________ 。
(2)常温下,某柠檬水的pH为3,则其中的c(OH-)为___________ 。
(3)浓度均为0.1mol/L的盐酸、硫酸和醋酸,其中pH最小的是___________ 。
(4)在某温度下,向含有BaSO4固体的BaSO4饱和溶液中加入少量稀硫酸,则c(Ba2+)___________ (填“增大”“减小”或“不变”,下同),Ksp___________ 。
(1)84消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈
(2)常温下,某柠檬水的pH为3,则其中的c(OH-)为
(3)浓度均为0.1mol/L的盐酸、硫酸和醋酸,其中pH最小的是
(4)在某温度下,向含有BaSO4固体的BaSO4饱和溶液中加入少量稀硫酸,则c(Ba2+)
您最近一年使用:0次
名校
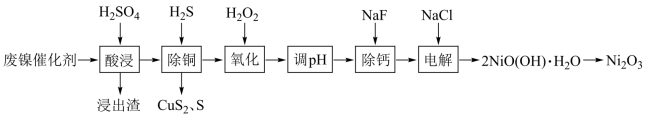
9 . 某科研人员以废镍催化剂(主要成分为 ,另含
,另含 、
、 、
、 、
、 )为原料回收镍,工艺流程如图:
)为原料回收镍,工艺流程如图:
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的 如表:
如表:
回答下列问题:
(1)浸出渣主要成分为___________ 、___________ (填化学式)。
(2)“除铜”时, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“氧化”的目的是将溶液中的 氧化为
氧化为 ,温度需控制在
,温度需控制在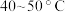 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是___________ 。
(4)“调 ”时,
”时, 的控制范围为
的控制范围为___________ 。
(5)“除钙”后,若溶液中 浓度为
浓度为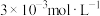 ,则
,则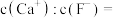
___________ 。[已知常温下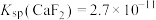 ]
]
 ,另含
,另含 、
、 、
、 、
、 )为原料回收镍,工艺流程如图:
)为原料回收镍,工艺流程如图:
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的
 如表:
如表: |  |  |
| 1.5 | 6.5 | 7.7 |
| 3.7 | 9.7 | 9.2 |
回答下列问题:
(1)浸出渣主要成分为
(2)“除铜”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)“氧化”的目的是将溶液中的
 氧化为
氧化为 ,温度需控制在
,温度需控制在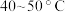 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是(4)“调
 ”时,
”时, 的控制范围为
的控制范围为(5)“除钙”后,若溶液中
 浓度为
浓度为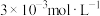 ,则
,则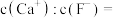
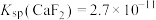 ]
]
您最近一年使用:0次
2021-12-09更新
|
982次组卷
|
4卷引用:江西省六校2021-2022学年高二上学期期末联考化学试题
10 . 在某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度___________ (填“增大”“减小”或“不变”,下同),
___________ ,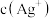
___________ 。

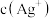
您最近一年使用:0次
2021-12-02更新
|
706次组卷
|
3卷引用:江西省宜春市丰城市东煌学校2023-2024学年高二上学期1月期末化学试题



